Desenvolvimento acelerado e a segurança das vacinas Covid‑19
O desenvolvimento rápido de uma vacina para prevenir a Covid‑19 é uma necessidade mundial. A capacidade de um agente viral de manter a propagação de uma pandemia é diminuída pela proteção coletiva, que pode acontecer através do uso generalizado de vacinas eficazes ou de ondas de infecção, até que 60 a 70% das pessoas desenvolvam imunidade.
Como a população humana é suscetível ao SARS-CoV-2, epidemias repetidas resultariam em mortalidade inaceitavelmente alta, graves problemas econômicos e grandes modificações no estilo de vida da população mundial. Portanto, há muitos benefícios no desenvolvimento de vacinas eficazes, principalmente se estas puderem ser utilizadas a tempo de evitar epidemias repetidas ou contínuas.
Entretanto, o desenvolvimento de vacinas é um processo caro e demorado, que costuma levar entre 10 e 15 anos. Várias vacinas candidatas precisam ser testadas para que se chegue a uma apta a ser registrada. Por causa do alto custo deste processo e das altas taxas de falha, os desenvolvedores costumam seguir uma sequência linear de etapas, com pausas para avaliar os dados e o processo de fabricação, e então decidir sobre o seguir ou não com o processo.
Em um desenvolvimento acelerado, como está ocorrendo com as vacinas para a Covid‑19, muitas etapas são realizadas em paralelo, aumentando o risco financeiro, mas dando rapidez ao processo.
Nessa abordagem, estudos de fase I podem ser realizados paralelamente a estudos em modelos animais.
Veja um comparativo do tempo de cada fase, no desenvolvimento tradicional e no desenvolvimento acelerado de vacinas:
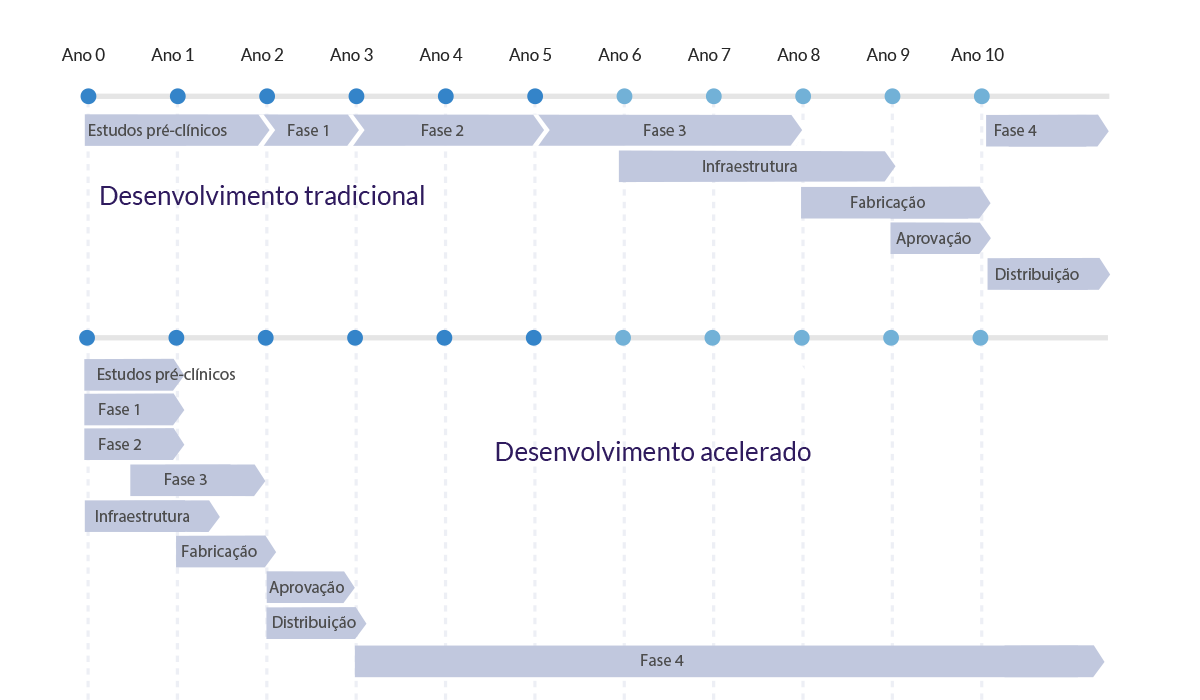
Fonte: Traduzido de What we know about Covid‑19 vaccine development (WHO, 2020)
No vídeo, dr. Akira Homma, pesquisador e professor emérito da Fiocruz, comenta sobre o processo acelerado de produção das vacinas Covid-19, os investimentos no desenvolvimento e produção, e da segurança, eficácia e qualidade desses imunobiológicos
Este método tornou possível o desenvolvimento de vacinas em tempo recorde, com a primeira vacina autorizada para uso, da Pfizer/BioNTech, em menos de um ano após o início da pandemia, seguidas pelas vacinas da Moderna, Oxford/AstraZeneca/Fiocruz e Sinovac/Butantan, que também receberam autorização de uso em vários países. Diversas outras vacinas estão em fase final de avaliação clínica e próximas de obter autorização para uso. De acordo com a Organização Mundial da Saúde (OMS), atualmente há 60 vacinas para Covid‑19 em desenvolvimento clínico e outras 172 em pré-clínico. Esses dados são do do documento Covid‑19 - Landscape of novel coronavirus candidate vaccine development worldwide - WHO.
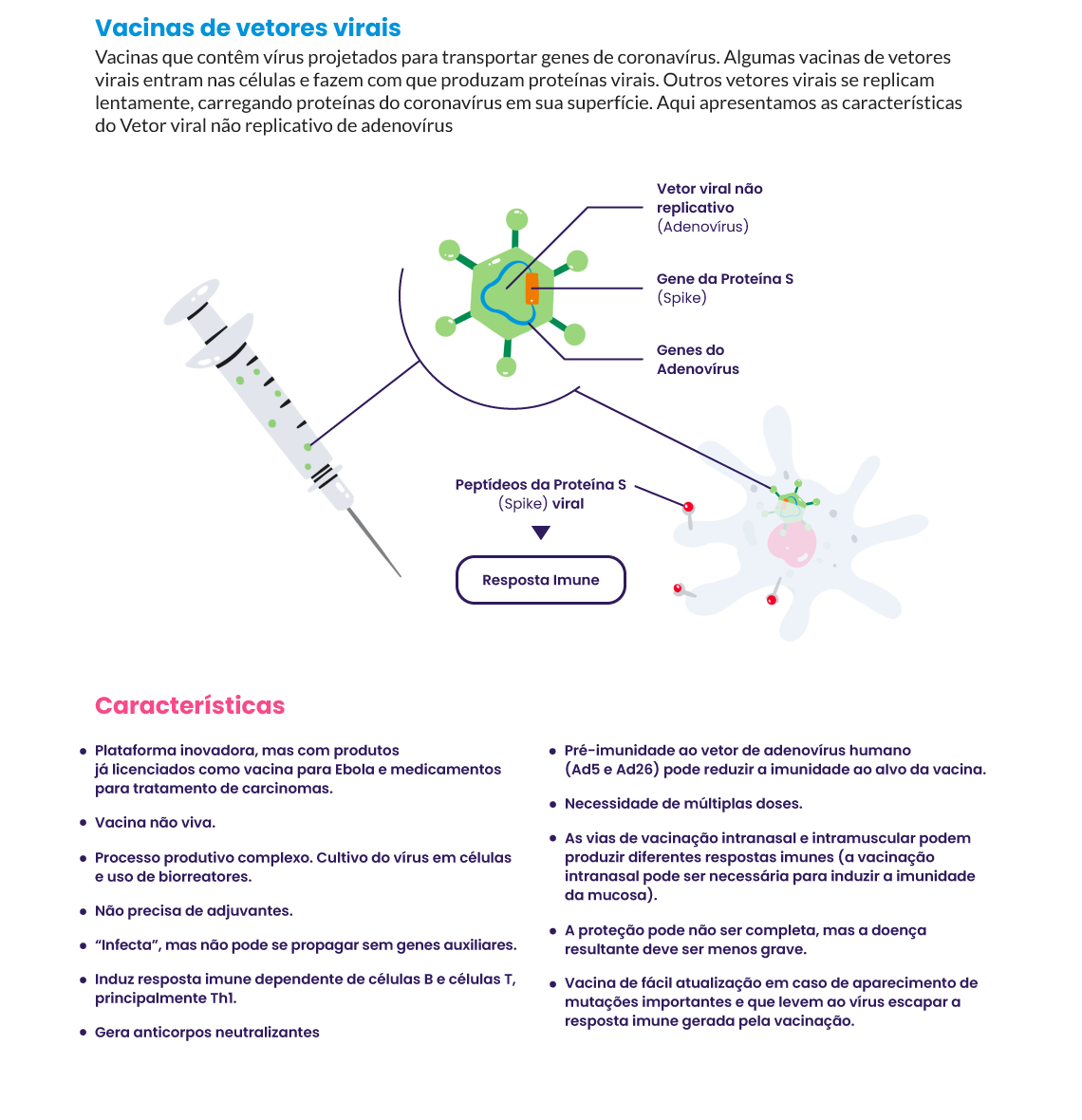
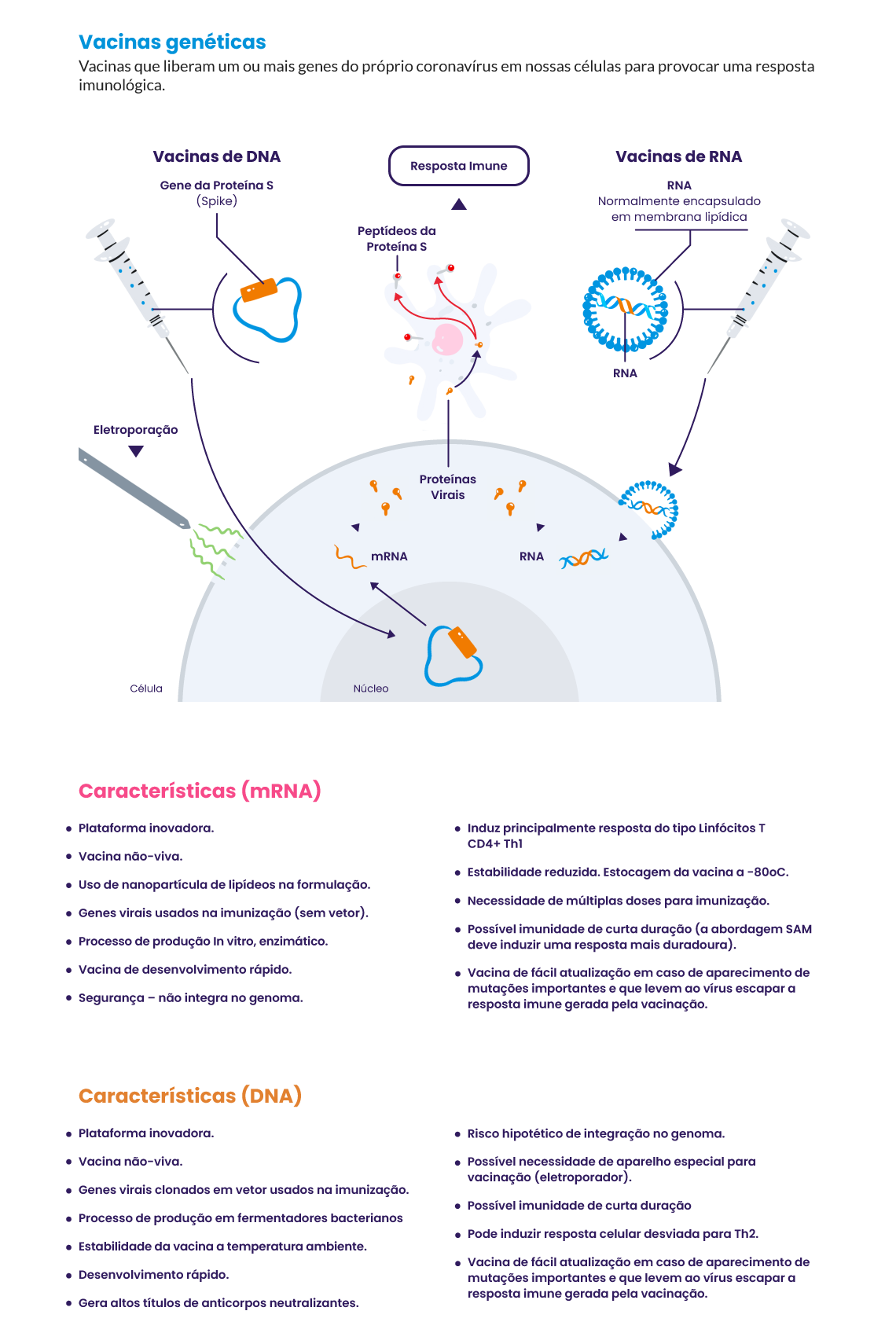
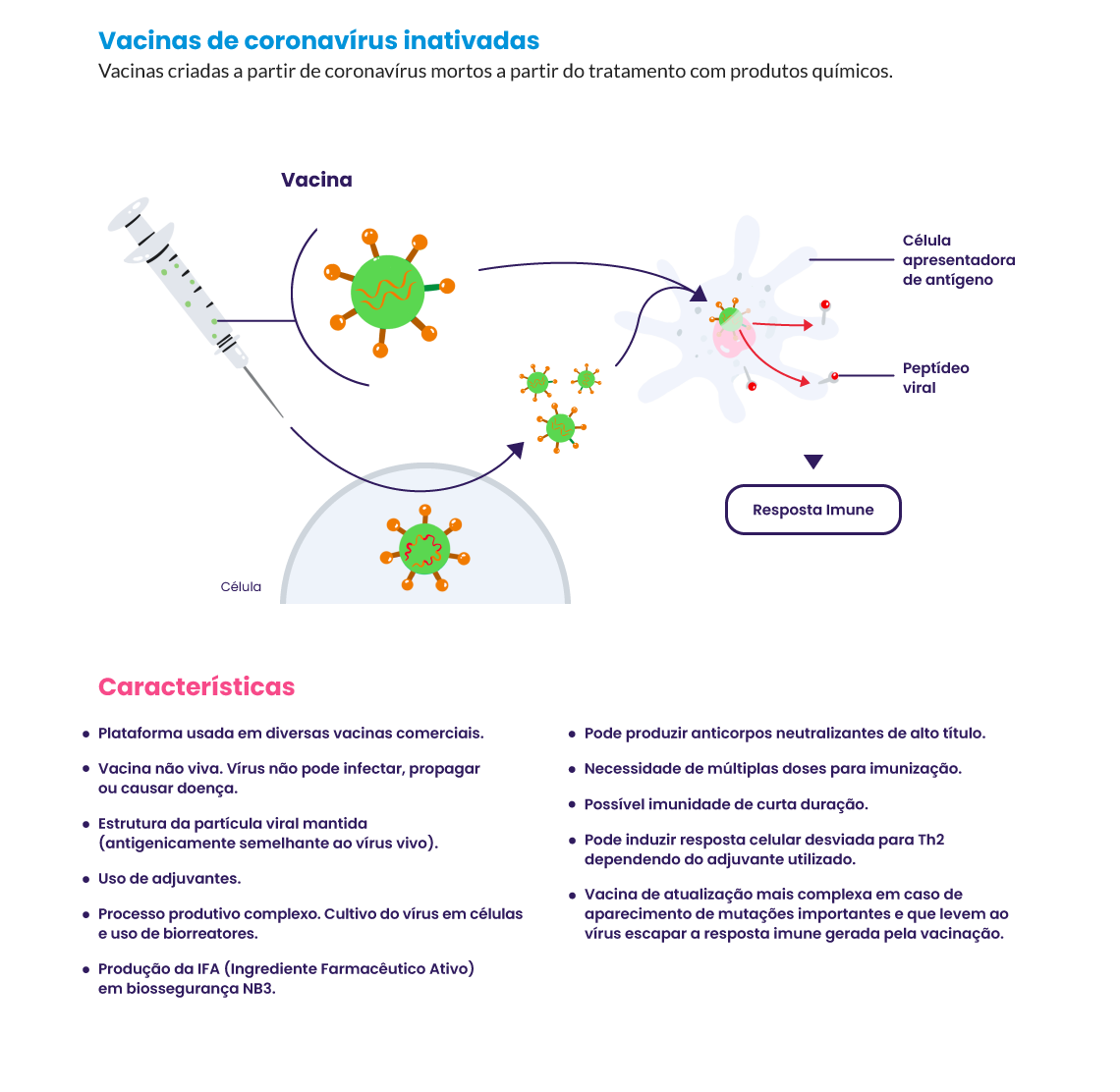
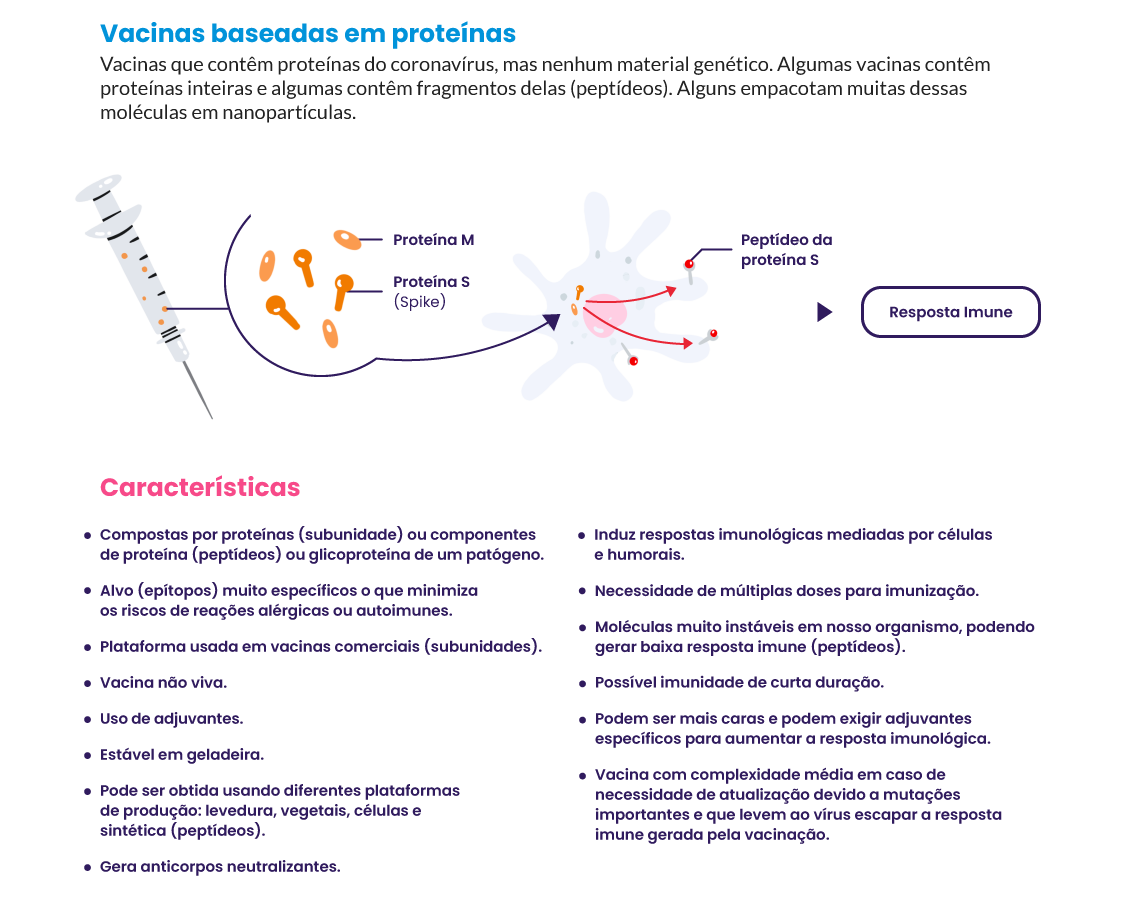
Muitas vacinas desenvolvidas utilizam plataformas inovadoras, como as de vetores virais e ácidos nucleicos (DNA e mRNA), que ainda possuem poucos dados de segurança e eficácia disponíveis. A principal vantagem dessas plataformas é que as vacinas podem ser produzidas sem o cultivo do vírus (necessário na produção de vacinas de vírus vivos atenuados e de vírus inativados), acelerando consideravelmente seu desenvolvimento. Entre estas plataformas, estão as de vetores virais e as de mRNA5. Outra vantagem é que elas podem ser facilmente adaptáveis a novas doenças, com plataformas tipo plug and play, que podem permitir a rápida produção de vacinas, mesmo para um patógeno desconhecido.
Veja as principais tecnologias para o desenvolvimento de vacinas para Covid‑19:
É preciso grande cuidado ao contraindicar as vacinas em virtude da possibilidade da ocorrência de eventos adversos, pois as pessoas não imunizadas estão sujeitas a adoecer e, além disso, representam um risco para a comunidade, pois poderão ser um elo na cadeia de transmissão. Embora nenhuma vacina esteja totalmente livre de provocar eventos adversos, os riscos de complicações graves causados são muito menores do que os riscos de complicações pelas doenças contra as quais elas conferem proteção.
A avaliação da segurança faz parte de todas as etapas de desenvolvimento de uma vacina. Os ensaios clínicos pré-registro são desenhados para avaliar a reatogenicidade e segurança da vacina em teste. Na fase III, a última etapa de estudos clínicos antes do registro, milhares de participantes recebem o produto. Porém, mesmo ensaios clínicos robustos podem não detectar eventos adversos raros ou muito raros, que ocorrem em frequências menores que 0,01%, ou seja, 1 em cada 1000 pessoas.
Por isso, a vigilância pós-mercado, ou farmacovigilância, é importante para monitorar estes eventos raros e muito raros, que podem ocorrer quando milhões de pessoas são vacinadas.