Módulo 3 | Aula 1
Fluxos, portarias e protocolos estabelecidos para a linha de cuidado da Transmissão Vertical do HTLV no Brasil
Objetivos de aprendizagem
- Conhecer os instrumentos do Sistema Único de Saúde (SUS) que normatizam a vigilância do HTLV.
- Conhecer os Protocolos Clínicos e Diretrizes Terapêuticas nacionais que integram o HTLV e a prevenção da transmissão vertical.
Como é estruturada a prevenção
No Brasil, as ações para prevenção da transmissão vertical do HTLV são estruturadas por fluxos, portarias e protocolos específicos, visando a prevenção e o manejo dessa infecção.
Os protocolos padronizam as ações dos profissionais de saúde, bem como orientam aos gestores sobre quais são as tecnologias em saúde que deverão ser ofertadas no âmbito do SUS, visando o cuidado contínuo e com qualidade. A notificação compulsória do HTLV em gestantes, puérperas e crianças expostas ao risco de transmissão vertical é um componente crucial desse sistema, permitindo o monitoramento dos casos e a implementação de ações com foco na prevenção.
Protocolos Clínicos e Diretrizes Terapêuticas e Incorporação de tecnologias no SUS
O SUS é organizado de forma complexa em um sistema tripartite, envolvendo municípios, estados e o nível federal. Um dos principais desafios do SUS, consiste na gestão de tecnologias e promoção do acesso aos avanços na ciência considerando os princípios da universalidade e equidade.
A Lei no 12.401/2011 regulamenta as decisões sobre a incorporação, a exclusão ou a alteração de novos medicamentos, produtos e procedimentos no âmbito do SUS. Ela define que os Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) são documentos que estabelecem orientações a serem seguidas pelos gestores do SUS. Isto porque, todos os itens listados no PCDT devem ser ofertados no SUS, conforme pactuação de responsabilidade entre municípios, estados e ente federal.
Itens presentes nos PCDTs
- Critérios para o diagnóstico da doença ou do agravo à saúde;
- Tratamento preconizado, com os medicamentos e demais produtos apropriados, quando couber;
- Posologias recomendadas;
- Mecanismos de controle clínico; e
- Acompanhamento e a verificação dos resultados terapêuticos.
Sobre Protocolos Clínicos e
Diretrizes Terapêuticas
Para saber mais sobre os Protocolos Clínicos e Diretrizes Terapêuticas (PCDT)
acesse a página web do Ministério da Saúde no GOV.BR disponível aqui.
Os PCDTs são uma ferramenta de linguagem objetiva feita para facilitar o acesso às principais informações e recomendações, possibilitando a sua utilização pela equipe multiprofissional de saúde. Para a elaboração dos PDCTs, o Ministério da Saúde se baseia em evidências científicas disponíveis na literatura, com análise e discussões com especialistas que constituem os Comitês Técnicos Assessores (CTAs).
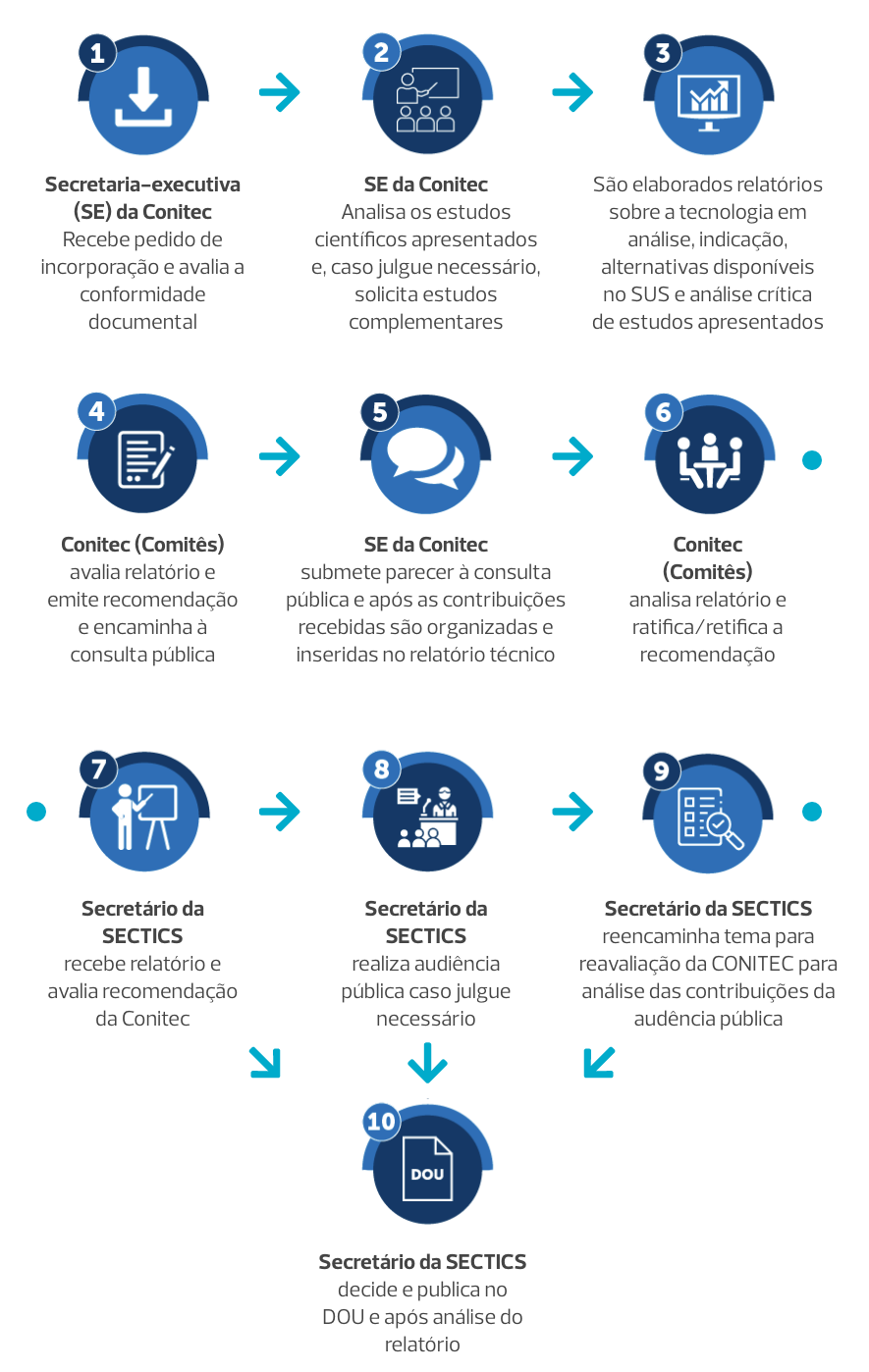
A constituição ou modificação de PCDTs, bem como o processo de incorporação, exclusão ou alteração de novos medicamentos, produtos e procedimentos no âmbito do SUS, são atribuições do Ministério da Saúde, assessorado pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec).

Legislação
O Decreto no 7.646, de 21 de dezembro de
2011, regulamenta o funcionamento da
Comissão Nacional de Incorporação de Tecnologias no SUS.
A Conitec é um órgão colegiado de caráter permanente, em que todas as decisões devem ser baseadas em evidência científica e considerar critérios de eficácia, segurança, efetividade e custo-efetividade das tecnologias em saúde. Somente produtos com registro na Agência Nacional de Vigilância Sanitária (Anvisa) podem ser avaliados quanto à sua incorporação ao SUS.
Acompanhe o fluxo de incorporação de tecnologia pela Conitec. A compreensão deste fluxo é fundamental para perceber os avanços que vêm sendo realizados no Brasil para manejo do HTLV no SUS, bem como os processos necessários para seguirmos avançando no país.
Protocolos Clínicos e Diretrizes Terapêuticas nacionais que integram o HTLV e a prevenção da transmissão vertical
A infecção pelo HTLV pode ser transmitida por via sexual e também de forma significativa de mãe para filho, especialmente durante a amamentação. Dessa forma, as orientações existentes no SUS para esse caso estão descritas nos PCDTs para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis (PCDT-IST) e PCDT para Prevenção da Transmissão Vertical de HIV, Sífilis e Hepatites Virais (PCDT-TV).
Ambos os PCDTs orientam sobre:
- O que é o HTLV-1 e 2.
- Vias de transmissão (com mais detalhamento para a transmissão vertical)
- Doenças associadas ao HTLV
- Sintomatologia
- Transmissão vertical por aleitamento
- Recomendações específicas para prevenção da transmissão do HTLV como: uso de preservativo em todas as relações sexuais; oferta de estratégia de redução de danos para pessoas que usam drogas injetáveis; contraindicação à amamentação em mães vivendo com HTLV-1/ HTLV-2, sendo sugerido o uso de inibidores de lactação e de fórmulas lácteas infantis.
Nota técnica norteadora das orientações para não amamentação por pessoas vivendo com HTLV e provimento de insumos no SUS
De forma complementar às orientações descritas nos PCDT-IST e PCDT-TV, o Ministério da Saúde publicou uma Nota Informativa nº 4/2021-CGIST/DCCI/SVS/MS, que dispõe sobre a recomendação do medicamento cabergolina 0,5mg e da fórmula láctea infantil na prevenção da transmissão vertical do HIV e do HTLV.
Você pode ler a íntegra na Nota Informativa aqui.
Tanto a cabergolina para pessoas vivendo com HIV ou HTLV, quanto a fórmula láctea para crianças expostas a estas infecções, podem ser adquiridas por estados e municípios com a verba do incentivo da vigilância em saúde, conforme Portaria GM/MS nº 232, de 07 de fevereiro de 2022. Esta portaria aprova os novos valores de transferência fundo a fundo do Incentivo às Ações de Vigilância, Prevenção e Controle das IST, Aids e Hepatites Virais, do Bloco de Manutenção das Ações e Serviços Públicos de Saúde, do Grupo de Vigilância em Saúde e dá outras providências.
Veja como fazer o cálculo para estimar a demanda anual de insumos para prevenção de transmissão vertical de HTLV no seu município:
Cálculo para estimar a demanda anual de insumos para prevenção de transmissão vertical de HTLV no seu município

Informações importantes
A inibição farmacológica da lactação deve ser realizada imediatamente após o parto, utilizando cabergolina 1 mg via oral (VO), em dose única (dois comprimidos de 0,5mg), administrada antes da alta hospitalar. Na ocorrência de lactação rebote, fenômeno pouco comum, pode-se realizar uma nova dose do inibidor.
No momento de alta da maternidade, deve ser disponibilizado um quantitativo de fórmula láctea infantil suficiente – mínimo de 4 (quatro) latas – até que a criança exposta esteja devidamente matriculada nos serviços de acompanhamento. Nestes serviços, a criança deve receber fórmula láctea infantil, pelo menos até 6 meses de vida. Este prazo pode ser estendido conforme avaliação e disponibilidade local.
Incorporação do rastreio e diagnóstico de HTLV em gestantes no âmbito do SUS
A aprovação do rastreio e do diagnóstico de HTLV em gestantes durante o pré-natal de maneira universal, e posterior incorporação no âmbito do SUS, foi um importante avanço para prevenir o HTLV. O rastreio e diagnóstico foram aprovados pela Conitec, em 2024, conforme solicitação feita pela Coordenação-Geral de Vigilância das Infecções Sexualmente Transmissíveis do Departamento de HIV, Tuberculose, Hepatites Virais e IST da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde.
Apesar de alguns municípios e estados terem sido pioneiros com a disponibilização desta testagem para gestantes, o rastreio e diagnóstico desse público não era uma realidade em todo o país. Os exames laboratoriais de diagnóstico para HTLV já se encontravam incorporados ao SUS, no entanto a recomendação de uso estava restrita a situações específicas.
O documento normativo da incorporação do uso dos testes nas gestantes é a Portaria SECTICS/MS Nº 13, de 3 de abril de 2024, que torna pública a decisão de incorporar, no âmbito do Sistema Único de Saúde – SUS, o exame para detecção pré-natal de infecção pelo Vírus T-Linfotrópico Humano (HTLV) 1 e 2 em gestantes.
Informações detalhadas do processo podem ser encontradas no Relatório de Recomendação da Conitec sobre detecção pré-natal de infecção pelo Vírus T-Linfotrópico Humano (HTLV) 1/2 em gestantes, disponível em aqui.
Desde então, a Secretaria de Atenção Primária à Saúde (SAPS), Secretaria de Vigilância em Saúde e Ambiente (SVSA) e Coordenação Geral de Laboratórios Públicos (CGLAB), juntamente com estados, municípios e laboratórios públicos (LACENs), vem trabalhando em conjunto para estruturação da rede de atendimento, no âmbito do SUS. Nesta estrutura, estão sendo considerados os testes de triagem, os testes confirmatórios e os testes para os casos de discordância entre o teste de triagem e o confirmatório.
Você pode encontrar o fluxograma do HTLV e outros fluxogramas para manejo clínico de ISTs na página do Ministério da Saúde, no Gov.br - clique aqui para conferir.
A testagem para rastreio de HTLV em gestantes deverá ser solicitada na primeira consulta de pré-natal, juntamente com os demais exames já preconizados, como o de HIV, sífilis, Hepatite B e Hepatite C.
Diferente destes, ainda não existe nenhum teste rápido para HTLV registrado na ANVISA, disponível para comercialização no Brasil. Esta tecnologia é de interesse para o SUS, uma vez que oportuniza a testagem e obtenção do resultado no primeiro atendimento, agilizando o cuidado, bem como promove ampliação do acesso ao diagnóstico, pela possibilidade de execução em ambientes que não possuem estrutura laboratorial, como unidades de atenção primária à saúde. Esta testagem e demais avanços nas incorporações de tecnologias no SUS para HTLV, serão acrescentados nos PCDT-IST e PCDT-TV à medida que estes protocolos vão sendo atualizados. Enquanto isso, questões sobre testagem, fluxos, e demais orientações de uso da nova tecnologia, são estabelecidas por meio de Notas Técnicas emitidas pelo Ministério da Saúde.
Guia de Manejo Clínico da Infecção pelo HTLV
Os guias elaborados por especialistas têm a função de nortear as ações dos profissionais de atenção à saúde, incluindo os profissionais de diagnóstico, conforme disponibilidades locais. Diferente dos PCDTs, os guias orientam à prática em saúde, mas não constituem um instrumento de gestão. Para os PCDTs, há a obrigatoriedade de provimento de todos os itens preconizados neste instrumento pelos gestores de saúde, conforme pactuação tripartite. No entanto, os guias são essenciais nas políticas públicas, porque auxiliam no direcionamento das prioridades de avanços a serem instituídos no SUS quanto à incorporação de novas tecnologias, práticas e procedimentos. Os guias são ferramentas para qualificação do cuidado e aperfeiçoamento da prevenção.
O Guia de Manejo Clínico da Infecção pelo HTLV voltado para a atenção às PvHTLV assintomáticas ou que já apresentam sintomas das várias doenças associadas ao HTLV, foi primeiramente publicado no Brasil no ano de 2002, e atualmente encontra-se na sua terceira edição (publicada em 2021). Trata-se de uma iniciativa dos especialistas do tema de HTLV em parceria com o Ministério da Saúde, que busca melhorar o atendimento às pessoas vivendo com o HTLV por profissionais da saúde. A terceira edição do Guia, publicada em 2021, reflete uma atualização integral das edições anteriores, incluindo inovações acadêmicas, tecnológicas, laboratoriais e terapêuticas para a melhoria da qualidade de vida das pessoas vivendo com o HTLV.
Linha de cuidado
As Linhas de Cuidado consistem em uma forma de articulação de recursos e das práticas de produção de saúde para a condução oportuna, ágil e singular dos usuários pelas possibilidades de diagnóstico e terapia, em resposta às necessidades epidemiológicas de maior relevância. Elas são orientadas por diretrizes clínicas, entre as unidades de atenção de uma dada região de saúde. A instituição da linha de cuidado também pode se dar no território, conforme pactuações locais.
A construção da Linha de cuidado para o HTLV, em âmbito nacional, é o próximo passo, após a incorporação das tecnologias necessárias no SUS e atualização dos PCDTs relacionados ao assunto.
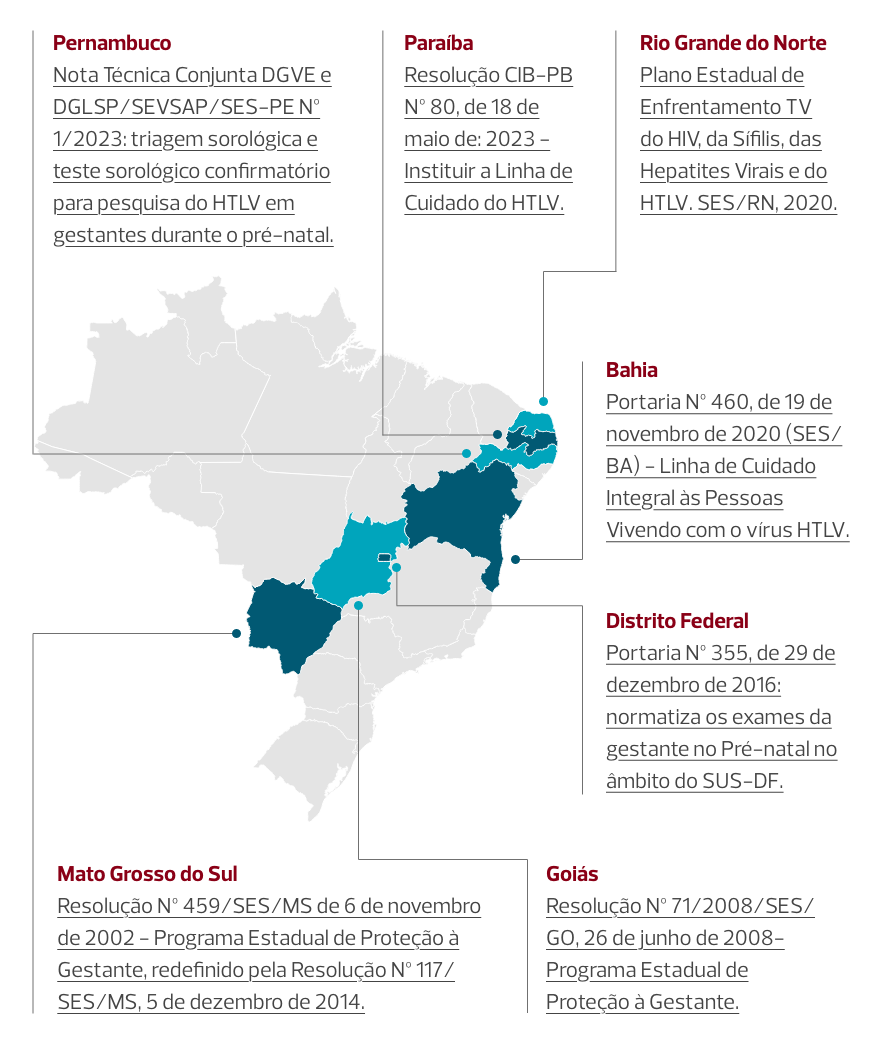
Conheça algumas iniciativas e normativas estaduais para HTLV
Vigilância Epidemiológica do HTLV e da Transmissão Vertical pelo HTLV
A Política Nacional de Vigilância em Saúde (PNVS) foi instituída em 12 de junho de 2018, por meio da Resolução n. 588/2018 do Conselho Nacional de Saúde (CNS). Como uma política pública de Estado, a PNVS possui caráter universal, transversal e orientador do modelo de atenção à saúde nos territórios. A PNVS considera a transversalidade das ações de vigilância em saúde sobre a determinação do processo saúde-doença. Ela engloba a vigilância epidemiológica, vigilância em saúde ambiental, vigilância em saúde do trabalhador e vigilância sanitária, com articulação dos saberes, processos e práticas relacionados a estas áreas citadas.

Acesse a Resolução na íntegra aqui.
De acordo com a PNVS, no seu Art. 6º, item XII, vigilância epidemiológica é:
-
“…conjunto de ações que proporcionam o conhecimento e a detecção de mudanças nos fatores determinantes e condicionantes da saúde individual e coletiva, com a finalidade de recomendar e adotar as medidas de prevenção e controle das doenças, transmissíveis e não-transmissíveis, e agravos à saúde.”
Neste contexto, existem as doenças, agravos e eventos de Saúde Pública que são de Notificação Compulsória, isto é, obrigatória, pelos serviços de saúde públicos e privados em todo o território nacional.
A notificação compulsória é um instrumento relevante para auxiliar o planejamento da saúde, definir prioridades de intervenção, além de permitir que seja avaliado o impacto das intervenções. Ela permite o monitoramento da disseminação de doenças pelas autoridades sanitárias e a instituição de medidas preventivas para reduzir o risco de transmissão.
Apesar de alguns estados e municípios terem instituído o HTLV como notificação compulsória localmente, nacionalmente a Infecção pelo HTLV, Infecção pelo HTLV em gestante, parturiente ou puérpera e Criança exposta ao risco de transmissão vertical do HTLV foram incluídas na Lista de Notificação Compulsória de Doenças, Agravos e Eventos de Saúde Pública no ano de 2024, por meio da Portaria GM/MS Nº 3.148, de 6 de fevereiro de 2024.
Para que essa notificação possa ser implementada no SUS, o Ministério da Saúde estabeleceu a composição de critérios de definição dos casos e seus respectivos CID 10 (Código Internacional de Doenças).
Além disso, foram definidos qual o tipo de notificação, quando notificar e periodicidade da notificação, para os seguintes eventos (clique em cada situação para ver mais):
- CID-10: Z22.6: Infecção pelo HTLV em gestante, parturiente ou puérpera. Esse código deve ser utilizado para notificar gestante com HTLV tipo I ou II.
- Definição de caso: Para fins de notificação, entende-se por gestante com HTLV aquela em que for detectada a infecção pelo Vírus Linfotrópico de Células T Humana Tipo 1 ou 2 (HTLV-1/2) durante a gestação/parto/puerpério ou as que já têm o diagnóstico prévio confirmado. Os critérios para conclusão diagnóstica da infecção pelo HTLV estão descritos em publicação específica do Ministério da Saúde – Guia de Manejo Clínico da Infecção pelo HTLV.
- Tipo de notificação: CASO CONFIRMADO: Devem ser notificados apenas os casos confirmados de infecção pelo HTLV, seguindo os fluxogramas vigentes.
- Quando notificar: A notificação da Infecção pelo HTLV em gestante, parturiente ou puérpera ocorrerá a cada evento gestacional (toda vez que mulher com HTLV estiver gestante deverá ser notificada).
- Periodicidade da notificação: Semanal.
- CID-10: Z20.8: Criança exposta ao risco de infecção pelo HTLV.
- Definição de caso: Entende-se por criança exposta aquela nascida de mãe infectada ou que tenha sido amamentada por mulheres infectadas pelo Vírus Linfotrópico de Células T Humana Tipo 1 ou 2 (HTLV-1/2). Os critérios para conclusão diagnóstica da infecção pelo HTLV materno estão descritos em publicação específica do Ministério da Saúde – Guia de Manejo Clínico da Infecção pelo HTLV.
- Tipo de notificação: Devem ser notificadas todas as crianças expostas ao HTLV durante a gestação, parto ou por amamentação.
- Periodicidade da notificação: Semanal.
- CID-10: B33.3: Infecção por retrovírus não classificada em outra parte (incluindo o Vírus Linfotrópico de Células T Humanas -HTLV).
- Definição de caso: Todo indivíduo com diagnóstico confirmado de infecção pelo Vírus Linfotrópico de Células T Humanas Tipo 1 ou 2 (HTLV-1/2), seguindo os fluxogramas vigentes. Os critérios para conclusão diagnóstica da infecção pelo HTLV estão descritos em publicação específica do Ministério da Saúde - Guia de Manejo Clínico da Infecção pelo HTLV.
- Tipo de notificação: CASO CONFIRMADO: Devem ser notificados apenas os casos confirmados de infecção pelo HTLV, seguindo os fluxogramas vigentes.
- Periodicidade da notificação: Semanal.
O processo de implementação da notificação do HTLV no SUS de forma compulsória encontra-se em andamento. Quando concluído, os casos deverão ser notificados no Sistema de Informação de Agravos de Notificação – Sinan. As notificações são realizadas com apoio da Ficha de Notificação, que é um instrumento padronizado utilizado para a coleta de informações sobre o (a) paciente, como dados pessoais, sintomas, diagnóstico, e histórico epidemiológico. Assim, os dados das fichas preenchidas são centralizados no Sinan, facilitando a análise epidemiológica e a tomada de decisões em saúde pública.
As fichas para a notificação compulsória, em nível nacional, de Infecção pelo HTLV, Infecção pelo HTLV em gestante, parturiente ou puérpera e Criança exposta ao risco de transmissão vertical do HTLV, encontram-se em processo de produção pelo Ministério da Saúde. Como passo seguinte, estas fichas serão pautadas no Comitê Técnico Assessor de Vigilância para análise dos especialistas e, por fim, implementadas no Sinan. O processo de implementação das fichas será acompanhado de documentos com orientações, de capacitações junto aos gestores e profissionais de vigilância e de atenção à saúde.
A notificação compulsória do HTLV somou esforços aos avanços nas políticas públicas para o vírus no Brasil. Esta notificação permitirá estimar o número de pessoas com HTLV e o quantitativo de insumos necessários para prevenção, diagnóstico e manejo da infecção, além de qualificar a rede de atenção para assistência a essa população. Para as crianças expostas, a notificação auxiliará no monitoramento dos casos pela vigilância epidemiológica e o acompanhamento ambulatorial dessas crianças até a conclusão do caso, com a definição do estado sorológico final.
Atualizações sobre o estabelecimento da vigilância epidemiológica do HTLV
Como o estabelecimento da vigilância epidemiológica do HTLV e a prevenção da transmissão vertical se encontram em processo de implantação no Brasil, atualizações frequentes deverão ocorrer, normatizadas através de PCDTs, Guias, Manuais e Notas Técnicas publicadas pelo DATHI/SVSA/MS. Para se manter atualizado, fique atento às novas publicações no site do Ministério da Saúde.
E, em casos de dúvidas e esclarecimentos específicos, veja com quem você pode falar:
Dúvidas sobre recomendações e condutas preconizadas no SUS, contactar Coordenação Geral de Vigilância em Infecções Sexualmente Transmissíveis (CGIST/DATHI/SVSA/MS) - cgist@aids.gov.br
Dúvidas sobre fluxos e manuais de diagnóstico em infecções sexualmente transmissíveis, contactar área de Diagnóstico do DATHI/SVSA/MS - diagnostico@aids.gov.br
Dúvidas sobre vigilância em infecções sexualmente transmissíveis, contactar área de Vigilância do DATHI/SVSA/MS - vigilancia@aids.gov.br
Você chegou ao final da aula
Nessa aula você aprendeu sobre os instrumentos do Sistema Único de Saúde (SUS) que normatizam a vigilância do HTLV e conheceu os Protocolos Clínicos e Diretrizes Terapêuticas nacionais que integram o HTLV e a prevenção da transmissão vertical.
AUTORES: Pâmela Cristina Gaspar e Mayra Gonçalves Aragón