Componentes da vigilância de EAPV
Detecção e notificação
Os EAPV podem ser detectados de forma ativa, por exemplo, em pesquisas na literatura e estudos clínicos de pós-comercialização (estudos de fase IV). Contudo, a vigilância passiva é o tipo mais frequente de vigilância pós-mercado realizada em relação aos EAPV. O principal objetivo da vigilância passiva é detectar sinais - eventos previamente desconhecidos ou quaisquer alterações no perfil de notificações de EAPV conhecidos.
Os profissionais de saúde (tanto das salas de vacinação quanto de hospitais/emergências) têm a responsabilidade de detectar e notificar EAPV, assim como referenciar os pacientes para atendimento médico adequado, quando necessário. Portanto, devem estar treinados para detectar:
- todos os casos de EAPV já com critérios definidos para determinada vacina;
- cluster de EAPV (dois ou mais casos do mesmo evento adverso em relação ao tempo, local ou vacina); e
- todos os outros eventos adversos que possam estar relacionados à vacinação.
Qualquer unidade de saúde, seja pública ou privada pode notificar um EAPV no sistema e-SUS Notifica. Já os os fabricantes e serviços privados podem realizar as notificações no sistema VigiMed.
Todos os EAPV devem ser notificados.
As unidades notificadoras (Unidades Básicas de Saúde, salas de vacinação, Unidades de Pronto Atendimento (UPA), prontos-socorros e hospitais) realizam a primeira avaliação de um EAPV classificando-o em grave ou não grave, ou erro de imunização.
Posteriormente, a notificação é feita no e-SUS Notifica. No caso de eventos adversos graves ou eventos adversos de interesse especial, a investigação deve ser iniciada em 48 horas.
O PNI recebe as notificações dos profissionais de saúde das salas de vacina do sistema público de saúde. A Anvisa recebe notificações dos fabricantes, serviços privados de vacinação e de qualquer cidadão - seja ele profissional de saúde ou não. Os sistemas para notificação e formulários, entretanto, são diferentes para a população em geral, profissionais de saúde e fabricantes, permitindo uma ampla captação de eventos adversos. Os serviços de saúde da esfera privada fazem a notificação de EAPV à Anvisa.
Confira o fluxograma completo de notificação e investigação de EAPV.
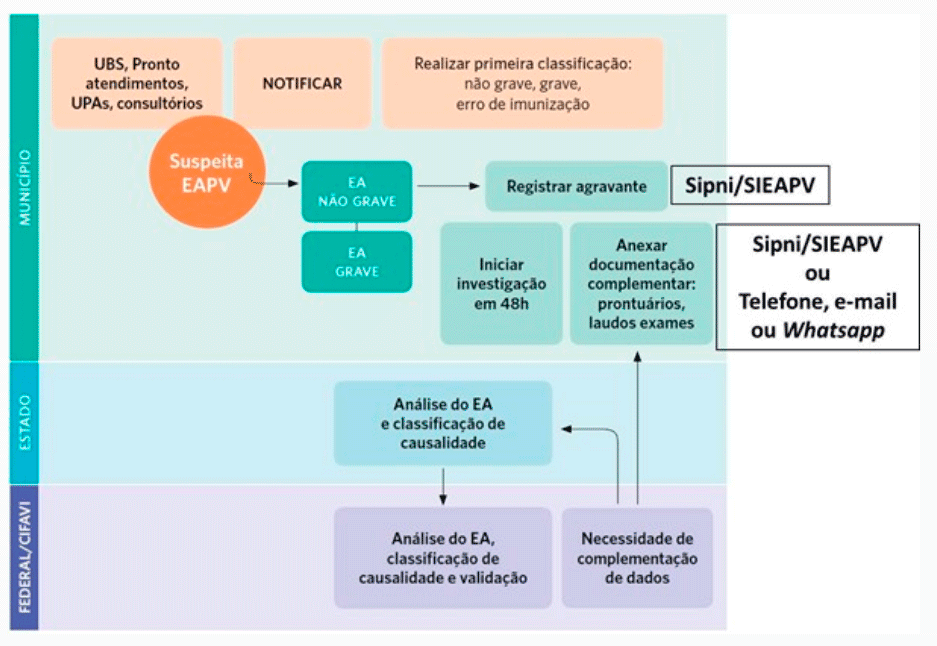
Fonte: Adaptado do Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação
A principal diferença entre as ações de farmacovigilância executadas pelo PNI e pela Anvisa é a fonte da notificação.
Investigação
Alguns EAPV necessitam de investigação com objetivo principal de determinar se a vacina foi ou não responsável pela ocorrência do evento. Os objetivos secundários da investigação de um EAPV são:
- confirmar diagnóstico e desfecho do EAPV;
- avaliar o processo operacional do programa de imunizações que possa ter causado o erro de imunização; pesquisar outros casos similares (cluster de EAPV); e
- comparar o risco de ocorrência de determinado evento adverso em vacinados e não vacinados.
De acordo com a OMS, devem ser investigados os eventos adversos graves; cluster de EAPV, sinais e eventos associados à uma nova vacina no mercado; EAPV que possam ter sido causados por erro de imunização; eventos adversos significativos e de causa desconhecida dentro de 30 dias após a vacinação e eventos adversos que possam causar apreensão na população.
Para que um processo de investigação seja bem-sucedido, a coleta de informações deve ser realizada criteriosamente e a mais completa possível. O envolvimento das equipes das salas de vacinação, vigilância epidemiológica, equipes assistenciais, laboratórios de referência e nível central (PNI) é essencial.
Para realizar a investigação, são coletados dados clínicos, epidemiológicos e laboratoriais, além de informações sobre o produto administrado. Pode ser necessária coleta de amostras clínicas para uma melhor elucidação do caso. É importante lembrar: se a coleta de amostras clínicas não for executada no tempo correto, pode comprometer ou inviabilizar a conclusão da investigação.
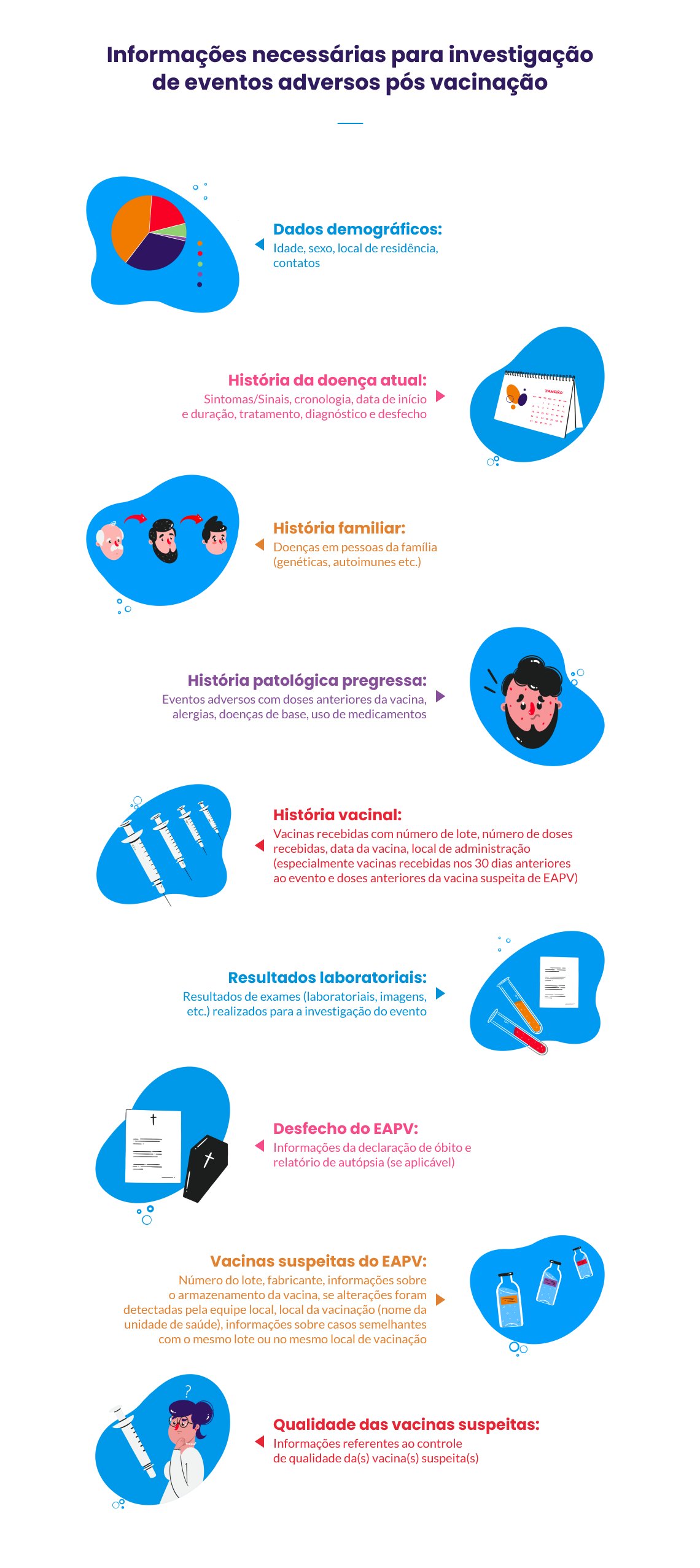
Fontes: Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação (4ª ed.) e WHO (2019)
Avaliação da causalidade
Avaliação da causalidade é uma revisão sistemática de dados de um caso suspeito de EAPV e visa determinar a probabilidade de uma associação causal entre eventos e vacinas recebidas. A avaliação da causalidade é a etapa mais importante e mais difícil na investigação de um EAPV cujo objetivo é determinar se existe uma relação causal entre a vacina e o evento 7,8. Em caso afirmativo, a avaliação da causalidade permite determinar o nível de certeza de tal associação.

Causalidade
É a relação entre dois eventos (causa e efeito), em que o segundo acontecimento é uma consequência do primeiro. A causa direta é um fator, na ausência do qual o efeito não ocorreria (causa necessária); às vezes, também existem vários fatores que podem precipitar o efeito (evento) ou funcionam como cofatores para que este possa ocorrer.
Os pré-requisitos para uma avaliação de causalidade são:
- A investigação do EAPV deve estar completa;
- Todas as informações relevantes devem estar disponíveis (documentos da investigação, prontuários médicos, resultados laboratoriais, e atestado de óbito, caso necessário).
- Deve haver um diagnóstico definitivo e válido para o sinal/sintoma, doença ou achado laboratorial anormal, evitando informar apenas os sintomas apresentados.
- Todas as vacinas que foram administradas antes do evento devem estar identificadas.
- Informações que podem enviesar a análise devem estar anonimizadas (nome do paciente ou do hospital, por exemplo).
A qualidade dos dados pode influenciar na avaliação da causalidade, pois informações incompletas podem considerar um EAPV inclassificável ou indeterminado devido à falta de evidências.
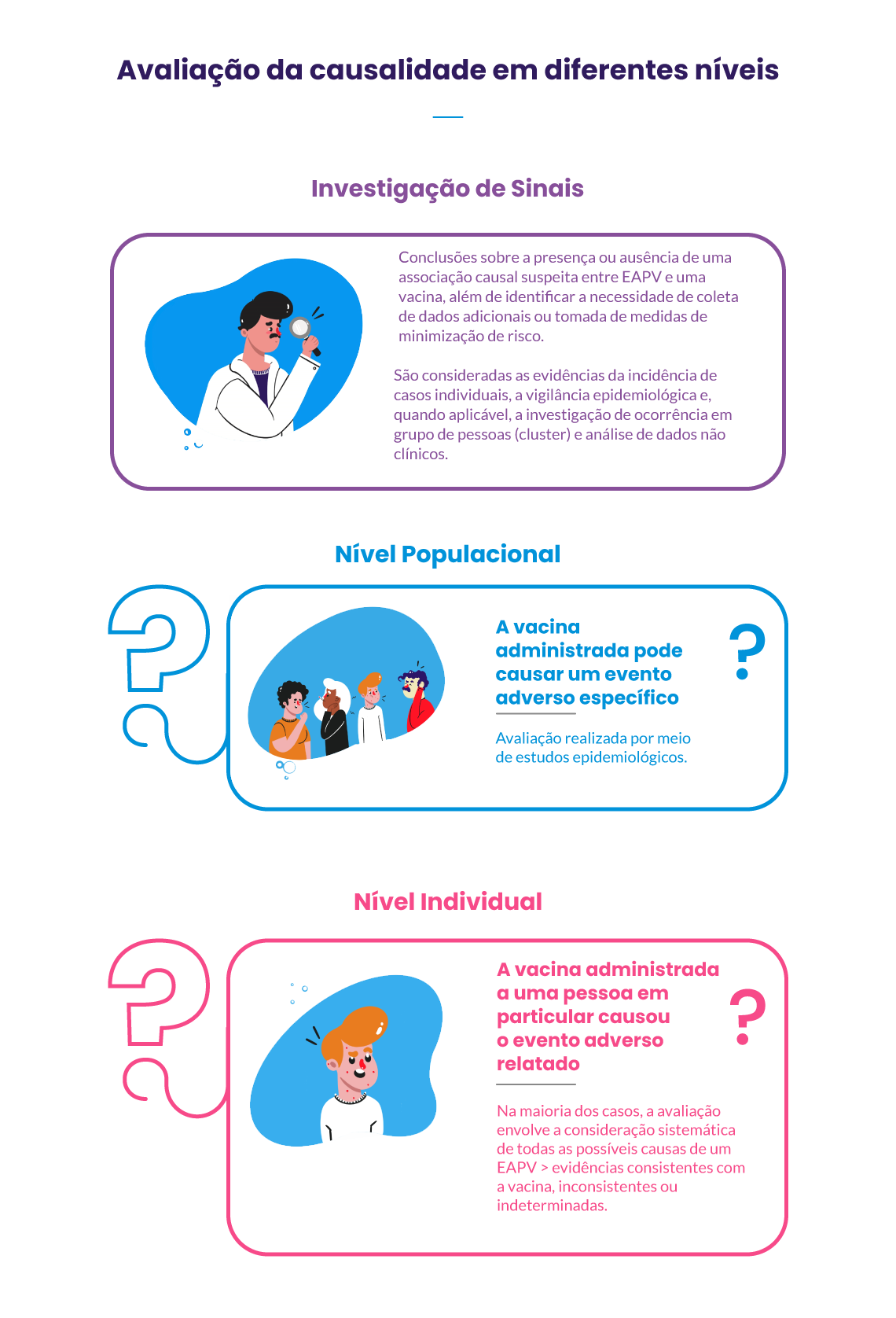
A investigação da relação causal entre a vacina e o EAPV é realizada em quatro etapas (Elegibilidade, Checklist, Algoritmo e Classificação) e em três níveis (populacional, individual e investigação de sinais).
Confira as etapas de avaliação da causalidade:
Determina se casos de EAPV satisfazem os critérios mínimos para avaliação de causalidade.
Nessa etapa, deve-se:
- Confirmar a relação temporal.
- Confirmar se os casos de EAPV satisfazem os critérios mínimos para avaliação de causalidade.
São critérios mínimos:
- Ter uma suspeita de EAPV (garantir que as informações necessárias estejam disponíveis e a investigação completa, e arquivar as informações do caso em um banco de dados).
- Identificar a vacina administrada antes da ocorrência do evento.
- Ter um diagnóstico válido (selecionar sinais, resultados laboratoriais anormais, sintomas e doenças que poderiam ter associação causal com a vacina).
- Ter uma definição de caso padronizada (Ministério da Saúde, Brighton Collaboration, literatura).
É a coleta sistemática das informações disponíveis.
O checklist contém variáveis que direcionam a coleta de dados a respeito dos antecedentes pessoais, fatores de risco, antecedentes vacinais, história clínica, evolução e exames laboratoriais, entre outros, e à busca de evidências para a avaliação e classificação de causalidade.
Conheça o checklist para avaliação de causalidade:
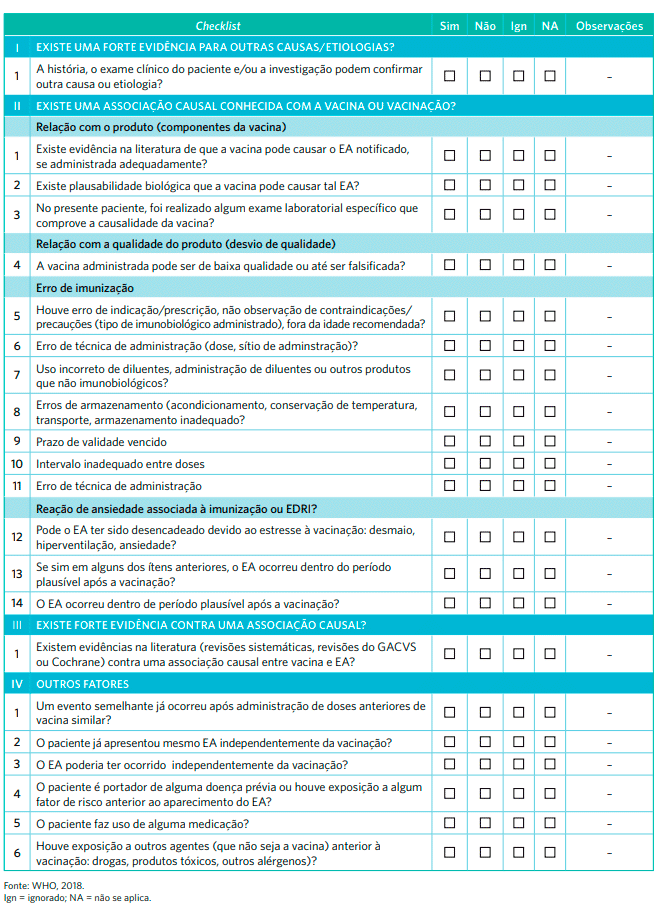
O Checklist está na página 58 do Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação (4ª ed.). Você pode baixar a imagem do Checklist aqui.
Essa etapa obtém uma tendência quanto à causalidade, a partir das informações do checklist.
Conheça o Algoritmo:
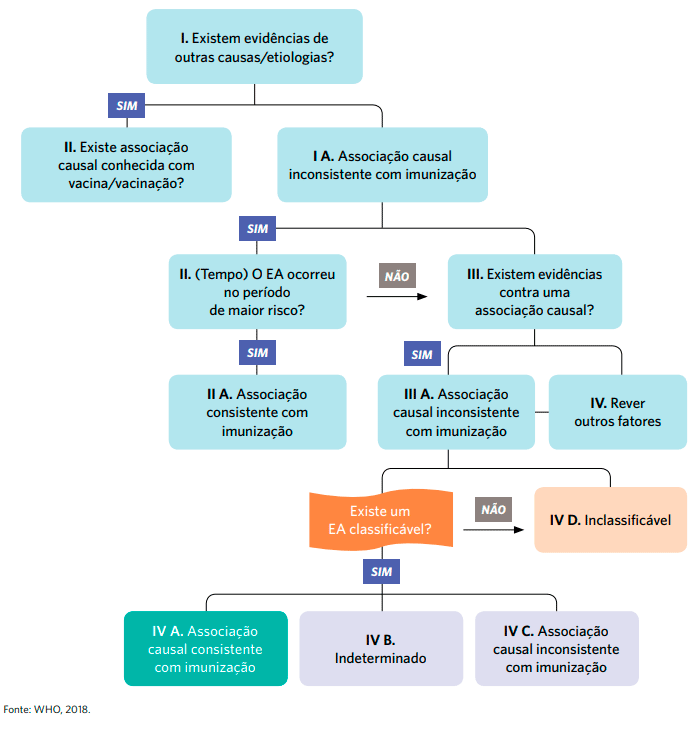
O fluxograma está na página 59 do Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação (4ª ed.). Você pode baixar a imagem do fluxograma aqui.
Essa etapa categoriza a associação do EAPV com vacina, com base na tendência determinada pelo algoritmo.
O quadro de classificação do EAPV segundo a causalidade está na página 62 do Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação (4ª ed.).
O quadro de classificação do EAPV segundo a causalidade está na página 62 do Manual de Vigilância Epidemiológica de Eventos Adversos Pós-Vacinação (4ª ed.). Você pode baixar a imagem do quadro aqui.