Registro de vacinas (produtos biológicos)
No Brasil, para que qualquer medicamento, incluindo vacinas, seja comercializado ou entregue ao consumo, é necessário que o mesmo obtenha a aprovação do registro sanitário pela Agência Nacional de Vigilância Sanitária (ANVISA), conforme preconizado pela Lei nº 6.360/1976.

Anvisa
Criada pela Lei nº 9.782, de 26 de janeiro 1999, A Agência Nacional de Vigilância Sanitária (Anvisa) é uma agência reguladora sob regime especial criada em com objetivo de é promover a proteção da saúde da população, através do controle sanitário da produção e consumo de produtos e serviços submetidos à vigilância sanitária, inclusive dos ambientes, dos processos, dos insumos e das tecnologias a eles relacionados, bem como o controle de portos, aeroportos, fronteiras e recintos alfandegados.

Para saber mais sobre a Agência, acesse a página da Anvisa ou as suas redes sociais - no Twitter @anvisa_oficial e Facebook @AnvisaOficial.
O fluxo regulatório “macro” para a solicitação de registro de um medicamento começa na regularização da empresa, passa pela correta identificação da petição que será solicitada, no caso, o registro, verificação e atendimento de toda documentação necessária, realizar o peticionamento e protocolo da petição na ANVISA e aguardar a análise da referida petição pela ANVISA.
Após a análise, a ANVISA pode emitir exigências técnicas para complementação de documentos, deferir (aprovar) ou indeferir (negar) a petição. Caso aprovado, o registro do medicamento terá validade de 10 anos.
Veja o fluxo para registro de produtos biológicos:
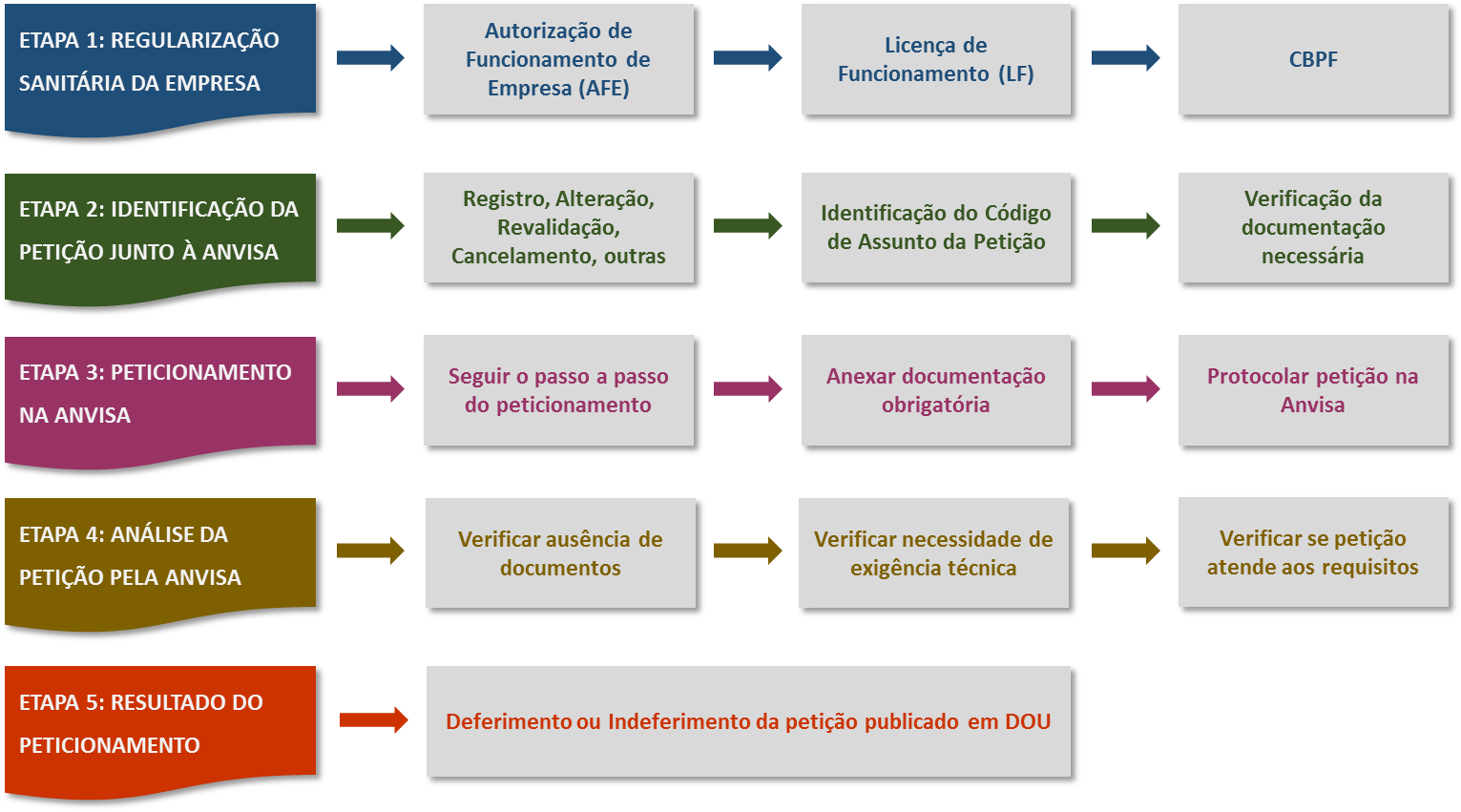
Fonte: Anvisa
As vacinas fazem parte de uma categoria de Produtos Biológicos e a norma da Anvisa que dispõe sobre o registro de Produtos Biológicos é a Resolução - RDC nº 55, de 16 de dezembro de 2010.
A vacina poderá ser registrada como produto biológico novo ou como produto biológico.
É o medicamento biológico que contém moléculas ainda não registradas no Brasil.
Para submissão do registro:
É necessário apresentar um dossiê de registro completo, ou seja, dados totais desde o desenvolvimento, estudos não-clínicos e clínicos (fases I, II e III), produção e controle de qualidade.
É o medicamento biológico não novo que contém moléculas com atividade biológica conhecida já registrado no Brasil.
Para submissão do registro:
Pode ser registrado utilizando a via de desenvolvimento individual ou a via de desenvolvimento por comparabilidade.
- Via de desenvolvimento individual é a via regulatória que poderá ser utilizada para obtenção de registro junto à ANVISA, na qual é necessária a apresentação de dados totais sobre o desenvolvimento, produção, controle de qualidade e dados não-clínicos e clínicos para demonstração da qualidade, eficácia e segurança do produto, uma vez que não será feita uma comparação. Nesta via, há a possibilidade de apresentação de um estudo de não inferioridade para demonstrar atividade terapêutica e segurança.
- Via de desenvolvimento por comparabilidade é a via regulatória que poderá ser utilizada para obtenção de registro junto à ANVISA, na qual pode ser utilizado o exercício de comparabilidade em termos de qualidade, eficácia e segurança, entre o produto em questão (comparável) e um produto biológico que será o comparador. Dessa forma, poderão ser apresentados dados comparativos e/ou reduzidos.
Uso emergencial, em caráter experimental, de vacinas contra a Covid‑19
A ANVISA estabeleceu a autorização temporária de uso emergencial, em caráter excepcional, de vacinas contra a Covid‑19 através da RDC Nº 444, de 10 de dezembro de 2020. Já os critérios mínimos a serem cumpridos pelas empresas para submissão à ANVISA do pedido de autorização temporária de uso emergencial estão definidos no Guia nº 42/2020.
Principais pontos referentes ao uso emergencial:
- A autorização de uso emergencial e temporária de uma vacina experimental contra a Covid‑19 é restrita a um público previamente definido, ou seja, não é destinada a toda população.
- A autorização não substitui o registro sanitário no Brasil e somente as vacinas com registro sanitário concedido pela Anvisa poderão ser disponibilizadas e comercializadas para toda a população.
- O pedido de uso emergencial e temporário deve ser submetido pela empresa desenvolvedora da vacina contra Covid‑19. Para isso, a respectiva empresa deve possuir Autorização de Funcionamento de Empresa (AFE) emitida pela Anvisa, com atividade de fabricar ou importar medicamentos.
- É necessário que a vacina seja acompanhada de um Dossiê de Desenvolvimento Clínico de Medicamento (DDCM) anuído pela Agência. Ademais, o ensaio clínico na fase 3 deve estar em andamento e condução no Brasil.
- A autorização para uso emergencial cessará automaticamente quando a respectiva vacina obtiver o registro sanitário e aprovação de preço na ANVISA.
- A autorização de uso emergencial e temporário da vacina Covid‑19 será válida até o reconhecimento pelo Ministério da Saúde de que não mais se configura a situação de Emergência em Saúde Pública de Importância Nacional. Findo o prazo concedido para uso emergencial, o produto ficará obrigado ao registro, sob pena de apreensão determinada pela ANVISA.
| Os dados avaliados para uso emergencial são: | |
|---|---|
|
Dados de eficácia e segurança Compreendem estudos clínicos e não clínicos. Estão incluídos aqui dados referentes aos estudos realizados em animais e humanos. |
Dados de tecnologia farmacêutica São dados referentes à qualidade, ao processo de fabricação e ao controle de qualidade. Eles têm como objetivo demonstrar que o produto será fabricado com qualidade e de forma consistente, dentro das especificações de uso. Esses dados também determinam o prazo de validade do produto. |
Os reguladores revisam os resultados completos do ensaio e os planos para a fabricação de uma vacina e decidem se dão a aprovação total.
Submissão contínua
A fim de tornar mais rápida a análise de dados referentes às vacinas contra Covid‑19 a serem registradas no país, a ANVISA implementou um novo procedimento de submissão chamado submissão contínua. A partir da adoção desse procedimento, não será preciso aguardar a disponibilização de todos os dados e documentos técnicos, bem como o preenchimento dos requerimentos regulatórios, para realizar a submissão formal do registro junto à Anvisa. Ou seja, conforme os dados forem gerados, estes deverão ser apresentados à Agência, de modo que o processo regulatório seja agilizado.
Para realização da submissão contínua, é necessário seguir o seguinte fluxo, determinado na Instrução Normativa – IN nº 77/2020:
- A empresa deve solicitar uma reunião de pré-submissão com a ANVISA.
- Após alinhamentos, deve ser submetida uma petição primária eletrônica, com o código de assunto 11800 - Produtos Biológicos – Avaliação de dados preliminares para Covid‑19. A petição deve conter uma justificativa, o status regulatório mundial e o cronograma de submissão.
- Após a submissão da petição primária, as empresas devem submeter as petições secundárias, que correspondem aos aditamentos específicos com documentação de qualidade (CMC) e de eficácia e segurança. Essas petições devem ser protocoladas com os seguintes códigos de assunto, respectivamente: 11811 - Produtos Biológicos – Aditamento CMC – Covid‑19 e 11812 - Produtos Biológicos – Aditamento eficácia e segurança – Covid‑19.
A cada protocolo de aditamento de CMC ou de eficácia e segurança, a Anvisa terá o prazo de até 20 dias para analisar, contados a partir da data do protocolo. A empresa somente poderá protocolar um novo aditamento de CMC ou de eficácia e segurança após a conclusão do aditamento de mesmo tipo anterior. A cada nova submissão, o mesmo procedimento se repetirá.
Após a conclusão da análise do último aditamento protocolado, e havendo dados de qualidade, eficácia e segurança para o estabelecimento de uma relação de benefício-risco positiva e robusta, que suportem o dossiê de registro, a empresa poderá protocolar o pedido de registro “formal” à ANVISA.
