Principais vacinas e status de desenvolvimento
O cenário de desenvolvimento de vacinas tem se mostrado muito dinâmico com novidades em relação ao andamento das fases de desenvolvimento mudando diariamente. Os pesquisadores estão atualmente testando 64 vacinas em ensaios clínicos em humanos e 19 já chegaram aos estágios finais de teste. Pelo menos 85 vacinas pré-clínicas estão sob investigação ativa em animais.
Conheça as principais Vacinas, sua fase de desenvolvimento e status de uso
| País - Desenvolvedor | Tipo | Fase | Status |
|---|---|---|---|
|
|
mRNA | 2/3 | Uso pleno ou emergencial em numerosos países; aprovação de uso emergencial concedida pela OMS em 31 de dezembro de 2020. |
|
|
mRNA | 3 | Uso pleno ou de emergência nos EUA, Canadá, União Europeia, Reino Unido e Israel. |
|
|
Adenovírus | 3 | Uso inicial na Rússia. Uso de emergência na Bielo-Rússia, Argentina. |
|
|
Adenovírus | 3 | Uso limitado na China. |
|
|
Adenovírus | 3 | Ainda não aprovada para uso. |
|
|
Adenovírus | 2/3 | Uso emergencial em vários países, incluindo Brasil, Reino Unido, Índia, Argentina, República Dominicana e El Salvador. |
|
|
Proteína | 3 | Uso inicial na Rússia. |
|
|
Proteína | 3 | Ainda não aprovada para uso. |
|
|
Inativado | 3 | Uso limitado na China. |
|
|
Inativado | 3 | Aprovado nos Emirados Árabes Unidos, Bahrein. Uso limitado na China. |
|
|
Inativado | 3 | Uso limitado na China e Emirados Árabes Unidos. |
|
|
mRNA sintético | 3 | Uso temporário ou emergencial como dose de reforço a partir de 12 anos. |
Fonte: COVID-19 Vaccine Tracker - atualizado em 15/01/2021
A primeira candidata à vacina para Covid‑19, desenvolvida pela empresa Moderna (vacina de mRNA), entrou em testes clínicos em humanos com uma rapidez sem precedentes em 16 de março de 2020.
No Brasil existem cinco vacinas em uso para humanos. Quatro delas, Comirnaty (Pfizer),Coronavac(Butantã), Jassen Vaccine (Janssen-Cilag) e Oxford/Covishield (Fiocruz/Astrazeneca) já foram utilizadas no esquema vacinal de forma emergencial e como reforço. As doses pediátricas da Comirnaty e Coronavac passaram a fazer parte do calendário infantil desde novembro de 2022 pela Anvisa. A nova vacina Comirnarty bivalente (Pfizer) entra em uso somente como dose de reforço a partir de fevereiro de 2023, e será apliacada segundo uma classificação de risco simplificada com três grupos — alto, médio e baixo risco — sendo que menores de 60 anos saudáveis não precisam de uma dose adicional da vacina além das três iniciais — o esquema primário de duas doses e um primeiro reforço.
O grupo de alto risco inclui idosos; adultos mais jovens com comorbidades significativas, pessoas com condições imunocomprometidas , incluindo crianças com 6 meses ou mais; pessoas grávidas, e profissionais de saúde da linha de frente.
Para o grupo de alto risco, a OMS recomenda um reforço adicional de 6 até 12 meses após a última dose, com o prazo dependendo de fatores como idade e condições de imunocomprometimento.
O grupo de médio risco inclui adultos saudáveis com menos de 60 anos sem comorbidades e crianças e adolescentes com comorbidades. Para essa população, é recomendada a série primária e as primeiras doses de reforço. O grupo de baixo risco inclui crianças e adolescentes saudáveis de 6 meses a 17 anos, para os quais doses primárias e de reforço são seguras e eficazes. No entanto, crianças imunocomprometidas e com comorbidades enfrentam um risco maior de Covid-19 grave e foram incluídas nos grupos de alta e média prioridade, respectivamente.
Produção de vacinas pela Fiocruz
A produção das vacinas no Brasil ainda depende da importação do IFA (Ingrediente Farmacêutico Ativo). A partir de agosto de 2021, a Fiocruz passará a entregar vacinas sem a necessidade de importação do IFA.
No vídeo, a presidente da Fiocruz, Nísia Trindade, fala do início da produção da Vacina Covid‑19 Fiocruz. O vídeo também explica as quatro etapas do processamento - formulação, envase e recravação, inspeção e rotulagem e embalagem. Ao final, o diretor de BioManguinhos, Maurício Zuma, fala do controle de qualidade na produção.
Veja o mapa das vacinas em teste no Brasil, publicado pela Agência Nacional de Vigilância Sanitária
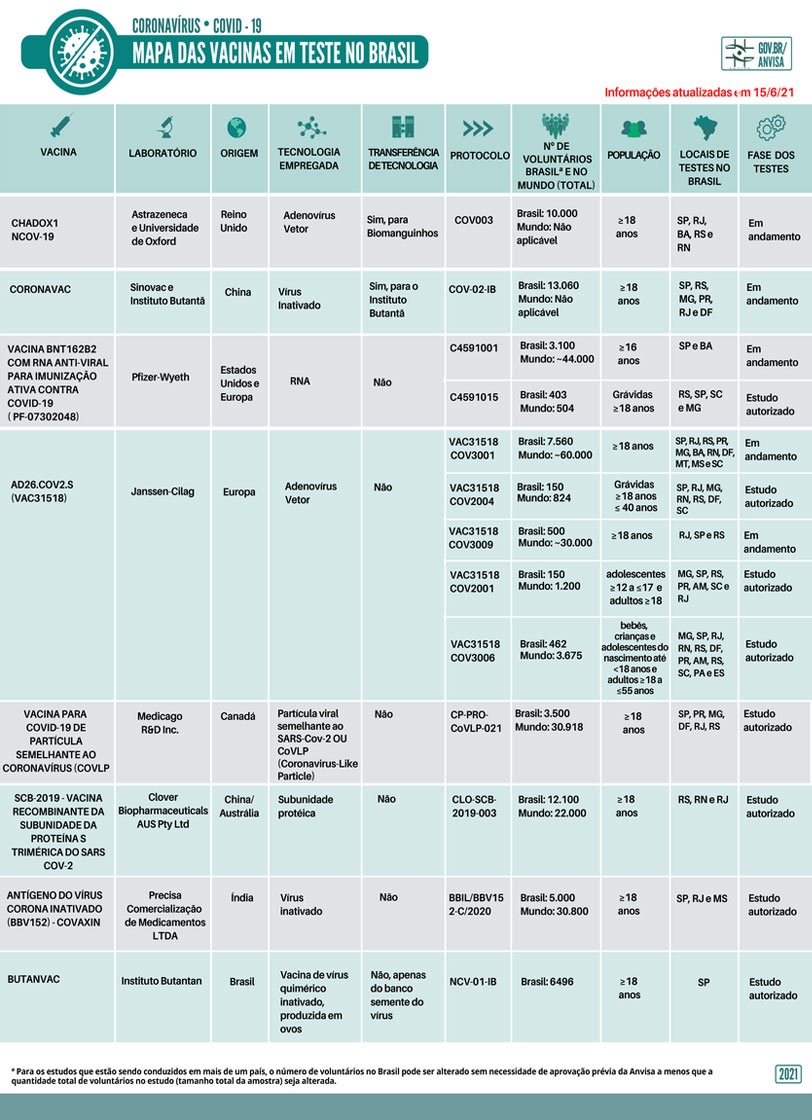
Fonte: Anvisa
Você pode acompanhar as atualizações do Mapa das Vacinas em Teste no Brasil, disponível na página da Anvisa.

Vacinas em uso no Brasil
As duas primeiras vacinas para Covid‑19 foram aprovadas para uso emergencial em 17 de janeiro de 2021. Elas já estão sendo aplicadas nos públicos prioritários, em todo o Brasil.
O relatório com as Bases Técnicas para Decisão do Uso Emergencial está disponível na página da Anvisa. Ele apresenta o parecer da Anvisa para aprovação das vacinas.
As bulas, com as características detalhadas dos imunizantes estão disponíveis na página das instituições e a Anvisa publicou um resumo das características
O registro nos sistemas SI-PNI e E-SUS é de fundamental para a integralidade e longitudinalidade do cuidado e é preciso ser garantido, durante a campanha de vacinação para Covid‑19.
Veja as características das vacinas autorizadas:
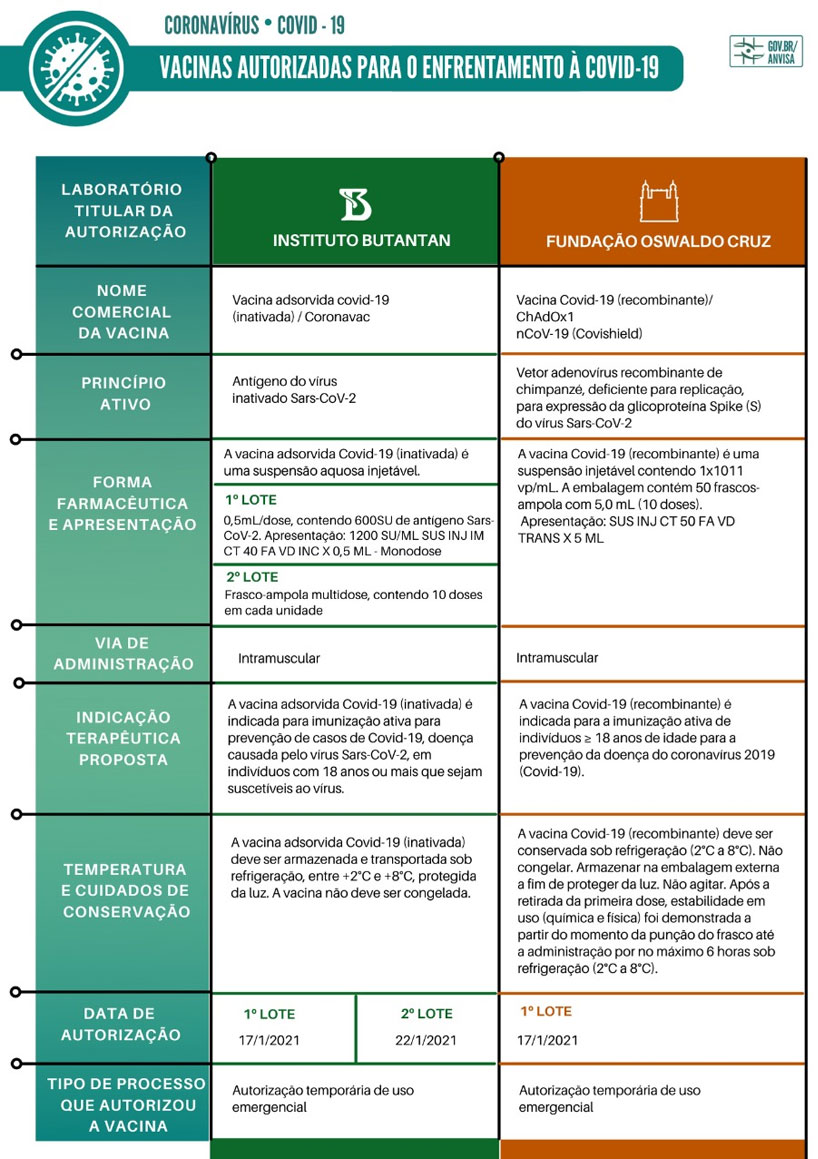
Fonte: Anvisa
Consulte as bulas completas na página das instituições
Produção acelerada de vacinas
O esforço global de P&D em resposta à pandemia do Covid‑19 é sem precedentes, em termos de escala e velocidade. Isso representa uma mudança fundamental na trajetória tradicional de desenvolvimento de vacinas, e exige novos paradigmas de desenvolvimento, envolvendo paralelismo em diversas fases (estudos pré-clínicos, clínicos e escalonamento), processos regulatórios inovadores e capacidade de produção em larga escala. O Dr. Akira Homma, pesquisador e professor emérito da Fiocruz, comenta sobre o processo acelerado de produção de vacinas, os investimentos no desenvolvimento e produção, e da segurança, eficácia e qualidade desses imunobiológicos.