Módulo 2 | Aula 2 Fluxo ético regulatório da pesquisa clínica no Brasil
Fluxo ético regulatório da pesquisa clínica no Brasil
Veja na imagem a seguir como é o fluxo regulatório da pesquisa clínica no Brasil.
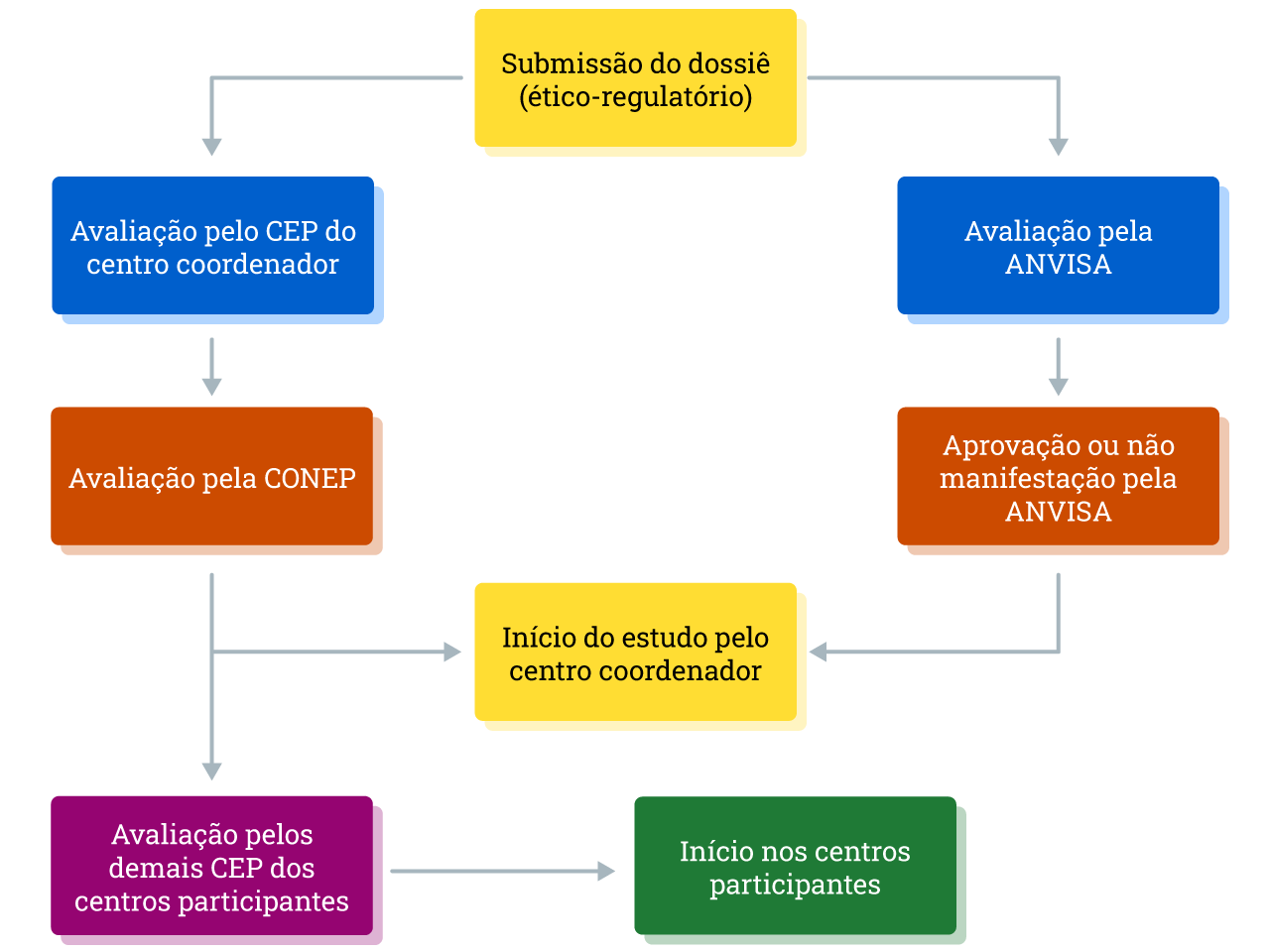
A avaliação e aprovação de ensaios clínicos no Brasil consiste na avaliação ética dos projetos de pesquisa clínica, que é realizada pelos CEPs e, caso necessário, também pela CONEP, e a avaliação regulatória pela ANVISA.
Na avaliação ética, todo o trâmite de comunicação e envio de documentos é feito pela “Plataforma Brasil”, sistema oficial referendado pela Res. CNS 466/12.
Antes de submeter um projeto de pesquisa clínica para o CEP, é necessário realizar o cadastro na Plataforma Brasil. Depois disso, você terá acesso à Plataforma e poderá inserir os dados do seu projeto de pesquisa clínica, ou delegar esta ação para outro usuário cadastrado, que seja parte de sua equipe.
De acordo com a legislação atual, é necessário preencher os campos com as informações referentes ao estudo clínico na Plataforma Brasil e anexar alguns documentos, são eles:
- Folha de rosto: todos os campos devem ser preenchidos, datados e assinados, com identificação dos signatários;
- Declarações relacionadas ao armazenamento de material biológico humano em biorrepositório ou biobanco;
- Declaração de compromisso do investigador responsável de anexar os resultados da pesquisa na Plataforma Brasil, garantindo o sigilo relativo às propriedades intelectuais e patentes industriais;
- Garantia de que os benefícios resultantes do projeto retornem aos participantes da pesquisa, seja em termos de retorno social, acesso aos procedimentos, produtos ou agentes da pesquisa;
- Orçamento financeiro: detalhar os recursos, fontes e destinação; forma e valor da remuneração do investigador; apresentar em moeda nacional ou, quando em moeda estrangeira, com o valor do câmbio oficial em Real obtido no período da proposição da pesquisa; apresentar previsão de ressarcimento de despesas do participante e seus acompanhantes, quando necessário, tais como transporte e alimentação e compensação material;
- Cronograma que descreva a duração total e as diferentes etapas da pesquisa, com compromisso explícito do investigador de que a pesquisa somente será iniciada a partir da aprovação pelo Sistema CEP/CONEP;
- Termo de Consentimento Livre e Esclarecido (TCLE) e/ou Termo de Assentimento Livre e Esclarecido (esse último, para o caso de grupos vulneráveis);
- Demonstrativo da existência de infraestrutura necessária e apta ao desenvolvimento da pesquisa e para atender eventuais problemas dela resultantes, com documento que expresse a concordância da instituição e/ou organização por meio de seu responsável maior com competência;
- Outros documentos que se fizerem necessários, de acordo com a especificidade da pesquisa, e;
- Projeto de pesquisa original na íntegra.
Você (ou outra pessoa delegada) deverá encaminhar toda esta documentação, chamada também de “Dossiê ético”, ao CEP institucional. Caso a instituição não tenha CEP, poderá solicitar à CONEP a avaliação pelo CEP de outra instituição.
Depois que você incluir as informações na Plataforma Brasil, o projeto é encaminhado ao CEP eletronicamente para a análise ética. Segundo a Norma Operacional 001/13 o CEP tem dez dias para realizar a conferência de documentos do projeto e terá 30 dias para emitir o parecer final: aprovado, pendente, não aprovado.
Caso o projeto de pesquisa tenha pendências, o pesquisador terá 30 dias para responder aos questionamentos do CEP. Caso não seja aprovado, o pesquisador pode entrar com recurso no CEP, e, no caso de nova não-aprovação, na CONEP. Em caso de estudo multicêntrico, ou seja, quando o estudo ocorrer em mais de um centro de pesquisa no país, a pesquisa deve inicialmente ser aprovada pelo CEP coordenador e, se aplicável, pela CONEP, e posteriormente ser replicada aos demais centros participantes e seus respectivos CEP.
O CEP de cada centro participante deverá aprovar o protocolo para avaliar tanto aspectos éticos quanto a viabilidade do projeto na instituição, levando em consideração também os aspectos de infraestrutura e recursos disponíveis. Caso alguma etapa da pesquisa seja realizada em local diferente do centro, este será um centro coparticipante e o CEP dele receberá para análise após a tramitação de cada centro.
Após a emissão do parecer de aprovação do estudo pelo CEP, em alguns casos, o projeto precisa ainda ser apreciado pela CONEP, dependendo da área temática em que se enquadra. Clique nos números e conheça as áreas temáticas especiais.
- Genética humana, quando o projeto envolver:
- Envio para o exterior de material genético ou qualquer material biológico humano para obtenção de material genético, salvo nos casos em que houver cooperação com o Governo Brasileiro;
- Armazenamento de material biológico ou dados genéticos humanos no exterior e no País, quando de forma conveniada com instituições estrangeiras ou em instituições comerciais;
- Alterações da estrutura genética de células humanas para utilização in vivo;
- Pesquisas na área da genética da reprodução humana (reprogenética);
- Pesquisas em genética do comportamento;
- Pesquisas nas quais esteja prevista a dissociação irreversível dos dados dos participantes de pesquisa.
- Reprodução humana: pesquisas que se ocupam com o funcionamento do aparelho reprodutor, procriação e fatores que afetam a saúde reprodutiva de humanos, sendo que nessas pesquisas serão considerados “participantes da pesquisa” todos os que forem afetados pelos procedimentos delas. Caberá análise da CONEP quando o projeto envolver:
- Reprodução assistida;
- Manipulação de gametas, pré-embriões, embriões e feto;
- Medicina fetal, quando envolver procedimentos invasivos.
- Equipamentos e dispositivos terapêuticos, novos ou não registrados no País.
- Novos procedimentos terapêuticos invasivos.
- Estudos com populações indígenas.
- Projetos de pesquisa que envolvam organismos geneticamente modificados (OGM), células-tronco embrionárias e organismos que representem alto risco coletivo, incluindo organismos relacionados a eles, nos âmbitos de: experimentação, construção, cultivo, manipulação, transporte, transferência, importação, exportação, armazenamento, liberação no meio ambiente e descarte.
- Protocolos de constituição e funcionamento de biobancos para fins de pesquisa.
- Pesquisas com coordenação e/ou patrocínio originados fora do Brasil, excetuadas aquelas com copatrocínio do Governo Brasileiro.
- Projetos que, a critério do CEP e devidamente justificados, sejam julgados merecedores de análise pela CONEP.
A Norma Operacional 001/13 determina que a CONEP tem 15 dias para realizar a conferência de documentos e terá o prazo máximo de 60 dias para emitir parecer final: aprovado, aprovado com recomendação, pendente, não aprovado.
Em caso de pendência, você terá 30 dias para responder, cabendo à CONEP emitir o seu parecer final em 45 dias. No caso de não aprovação, o pesquisador pode entrar com recurso, apresentando fato novo que justifique a reanálise.
Se o seu projeto de pesquisa clínica for um ensaio clínico para fins de registro de um item (ex.: medicamento, vacina, produto para saúde), é necessário obter autorização da ANVISA, que é realizada paralelamente à avaliação do sistema CEP/CONEP.
A submissão do projeto à ANVISA é realizada pelo patrocinador da pesquisa. Caso a pesquisa seja financiada por uma agência de fomento, a ANVISA entende que o pesquisador, neste caso, também atua como patrocinador e, portanto, deve ser o responsável pela preparação desta documentação (pesquisador-patrocinador).
Para realizar a submissão à ANVISA, conforme a RDC 09/15, você deverá encaminhar um Dossiê de Desenvolvimento Clínico de Medicamento (DDCM). Um DDCM é composto basicamente de quatro conjuntos de documentos principais. Clique nos boxes destacados e veja as listas de documentos.
Plano de Desenvolvimento do Medicamento
O Plano de Desenvolvimento do Medicamento deve listar:
- IFA ou substância ativa;
- Categoria de medicamento (sintético, biológico, fitoterápico ou radio fármaco);
- Classe terapêutica;
- Via de administração;
- Mecanismo de ação;
- Indicações a serem estudadas;
- Objetivos gerais e a duração planejada para o desenvolvimento clínico; e
- Informações sobre fase, desenho, desfechos, comparadores, objetivos, população a ser estudada, hipótese(s), número estimado de participantes e planejamento estatístico para cada ensaio clínico planejado.
Brochura do Investigador
A Brochura do Investigador deve listar:
- Medicamento experimental;
- Formulação;
- Efeitos farmacológicos e toxicológicos do medicamento experimental em animais e em seres humanos, quando aplicável;
- Informações de segurança e eficácia em humanos obtidos a partir de ensaios clínicos já realizados, e;
- Possíveis riscos e eventos adversos relacionados ao medicamento experimental, baseados em experiências anteriores, bem como precauções ou acompanhamentos especiais a serem seguidos durante o desenvolvimento.
Dossiê do Medicamento Experimental
O Dossiê do Medicamento Experimental deve conter os seguintes documentos:
- Descrição do IFA ou substância ativa, incluindo:
- Características físico-químicas, organolépticas e biológicas;
- Nome e endereço do fabricante;
- Método geral de obtenção;
- Metodologia analítica validada e limites aceitáveis para garantir identidade, qualidade e pureza, e;
- Resultados de estudos de estabilidade.
- Descrição do medicamento experimental, incluindo:
- Lista de todos os componentes ativos e inativos com suas respectivas funções, inclusive aqueles que não estejam presentes no medicamento acabado;
- Composição quantitativa;
- Descrição geral do processo de fabricação e embalagem com informações sobre a capacidade dos equipamentos;
- A metodologia analítica e os limites aceitáveis para garantir a identidade, e;
- Resultados de estudos de estabilidade que assegurem a utilização do medicamento experimental nos ensaios clínicos planejados.
- Descrição do placebo, quando aplicável, incluindo:
- Composição;
- Características organolépticas;
- Processo de fabricação; e
- Controles analíticos.
- Descrição do medicamento comparador quando este for modificado para a realização do ensaio clínico, incluindo informações que assegurem a manutenção das características originais do medicamento;
- Documentação referente ao controle de transmissibilidade de Encefalopatias Espongiformes Transmissíveis (EET), segundo as normas sanitárias vigentes ou justificativas da isenção deste documento;
- Modelo de rótulo(s) do(s) produto(s) sob investigação;
- Análise crítica de estudos farmacológicos e toxicológicos não clínicos que garantam segurança para realização do desenvolvimento clínico proposto e informações sobre os locais de condução destes estudos, bem como onde seus registros estão disponíveis para consulta, incluindo uma declaração de que cada estudo foi realizado em conformidade com as BPL ou justificativa de ausência. Descrição dos riscos conhecidos a respeito do medicamento experimental baseado em estudos toxicológicos em modelos animais ou testes in vitro já realizados ou classe terapêutica estudada; avaliação de risco/benefício relacionada ao plano de desenvolvimento;
- Análise crítica de ensaios clínicos já realizados, se aplicável, incluindo o embasamento de eficácia e segurança. Descrição dos riscos já conhecidos a respeito do medicamento experimental baseado em ensaios clínicos já realizados ou classe terapêutica estudada; avaliação de risco/benefício relacionada ao plano de desenvolvimento;
- No caso do medicamento experimental já possuir registro no Brasil, somente as informações que subsidiem as alterações pós-registro propostas devem ser submetidas no DDCM;
- Nos casos em que se desejar realizar um ensaio clínico com um medicamento que já possui um DDCM aprovado pela ANVISA, é possível utilizar as informações já enviadas pelo detentor do DDCM inicial, caso este o autorize, sem a necessidade de ressubmissão de toda a documentação. Quando não for apresentada uma autorização do detentor inicial, deve-se submeter à Anvisa toda a informação por meio de literatura atualizada e indexada que dê suporte ao racional de desenvolvimento proposto;
Dossiê específico
O Dossiê específico do ensaio clínico deve ser composto dos seguintes documentos:
- Formulário de apresentação de ensaio clínico devidamente preenchido, disponível no sítio eletrônico da Anvisa;
- Comprovante de pagamento, ou de isenção, da Taxa de Fiscalização de Vigilância Sanitária, mediante Guia de Recolhimento da União (GRU);
- Protocolo de ensaio clínico de acordo com as BPC;
- Comprovante de registro do ensaio clínico em base de dados de registro da International Clinical Trials Registration Platform / World Health Organization (ICTRP/WHO) ou outras reconhecidas pelo International Committee of Medical Journals Editors (ICMJE), e;
- Parecer Consubstanciado do Comitê de Ética em Pesquisa (CEP) emitido para o primeiro centro de ensaio clínico a encaminhar o protocolo para análise pelo CEP.
Além destes documentos, o DDCM ainda é composto por:
Após receber o DDCM, a ANVISA avaliará a documentação em até 90 dias. Caso não haja manifestação da agência nesse prazo, o desenvolvimento clínico poderá ser iniciado após as aprovações éticas pertinentes (caso seja necessária a aprovação da CONEP, por exemplo).
No caso de Desenvolvimento nacional e de produtos biológicos, e estudos de fase I e II, essa avaliação se dá em até 180 dias.
Esta aprovação pode ser manifestada através da emissão de um Comunicado Especial (CE), mencionando aqueles ensaios clínicos que poderão ser conduzidos no país para cada DDCM. Caso a manifestação não ocorra, um documento que permite a importação ou exportação do(s) produto(s) em investigação, o Documento para Importação do(s) produtos(s) sob investigação do DDCM, pode ser emitido. A ANVISA disponibilizou no seu site alguns guias para auxiliar na confecção da documentação.
Quando o Ensaio Clínico é iniciado, a ANVISA deve ser notificada. Esta data corresponde ao recrutamento do primeiro participante da pesquisa no Brasil. Esta notificação é realizada através do Formulário de Notificação de Início de Ensaio Clínico no Brasil, que também está disponível no site da ANVISA.
Todas estas etapas de aprovação ética e regulatória dos projetos de pesquisa clínica são importantes para garantir que os direitos, segurança e bem-estar dos participantes da pesquisa sejam respeitados. Nenhuma etapa do projeto pode ser realizada antes de todas as aprovações pertinentes.
Agora, que você já navegou por todo conteúdo desta aula, faça os exercícios de fixação para apoiar seu aprendizado!




