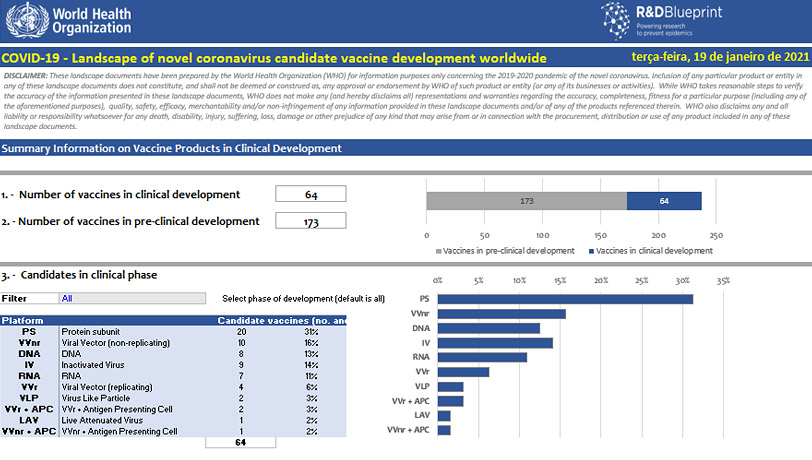
Evidências sobre as vacinas
Antes de uma vacina ser administrada na população, ela passa por estudos pré-clínicos, que são os estudos em animais, e estudos clínicos, que são os estudos em seres humanos. Os estudos clínicos são realizados em três fases. Nestes estudos são avaliados dados de eficácia, segurança e reatogenicidade da vacina. Veja as fases de desenvolvimento de uma vacina no Módulo 1 - Desenvolvimento: processos, etapas e resultados.
Etapas regulatórias
Ao longo do desenvolvimento científico e tecnológico da vacina, há etapas regulatórias que precisam ser realizadas. Confira:
Aprovação regulatória para o desenvolvimento – Uma pesquisa clínica no Brasil, só pode iniciar-se a partir da aprovação de protocolos pelos órgãos do o Sistema CEP-CONEP (Comitês de Ética em Pesquisa e Comissão Nacional de Ética em Pesquisa), conforme as diretrizes da Resolução nº 466, de 12 de dezembro de 2012. No caso de vacinas que utilizam micro-organismos, é necessária a avaliação da Comissão Técnica Nacional de Biossegurança – CTNBio, conforme previsto na Resolução Normativa nº 21, de 15 de junho de 2018. Também é necessário obter a aprovação da Agência Nacional de Vigilância Sanitária (Anvisa), que confere qualidade para a realização dos ensaios clínicos, como a adesão às Boas Práticas Clínicas (BPC).
Aprovação regulatória para registro da vacina – Encerrado o processo de desenvolvimento científico e tecnológico, comprovadas a eficácia e segurança da vacina, a empresa desenvolvedora deverá proceder ao registro sanitário junto aos órgãos competentes. No que diz respeito a vacina COVID-19, neste cenário de pandemia, a Anvisa publicou a RDC n° 348, de 17 de março de 2020, que trata sobre a priorização de análise de pedidos de registro de medicamentos/produtos biológicos durante a pandemia, agilizando o processo que poderia demorar anos.
Regulação do Preço – Nesta etapa é estabelecido o preço da vacina pela Câmara de Regulação do Mercado de Medicamentos (CMED), órgão interministerial responsável pela regulação econômica do mercado de medicamentos no Brasil, do qual a Anvisa é a Secretaria-Executiva. A partir daí, é autorizada a comercialização da vacina no Brasil.
Incorporação no Sistema Único de Saúde – SUS - O processo de incorporação de tecnologias no SUS foi regulamentado pela Lei nº 12.401, de 28 de abril de 2011 e o Decreto nº 7.646, de 21 de dezembro de 2011.

Monitoramento de vacinas em desenvolvimento contra Sars-CoV-2
Para saber mais sobre o desenvolvimento de vacinas Covid-19, consulte o Relatório Técnico Monitoramento de vacinas em desenvolvimento contra Sars-CoV-2.
A eficácia da vacina pode se referir à capacidade de proteger os vacinados contra o adoecimento de Covid-19, as formas graves da doença, ou mesmo contra a infecção pelo Sars-CoV-2, vai depender dos desfechos avaliados nos estudos. Segurança e reatogenicidade se referem aos eventos adversos pós-vacinais ocorridos durante os estudos clínicos.
Existem 4 vacinas em uso no Brasil:
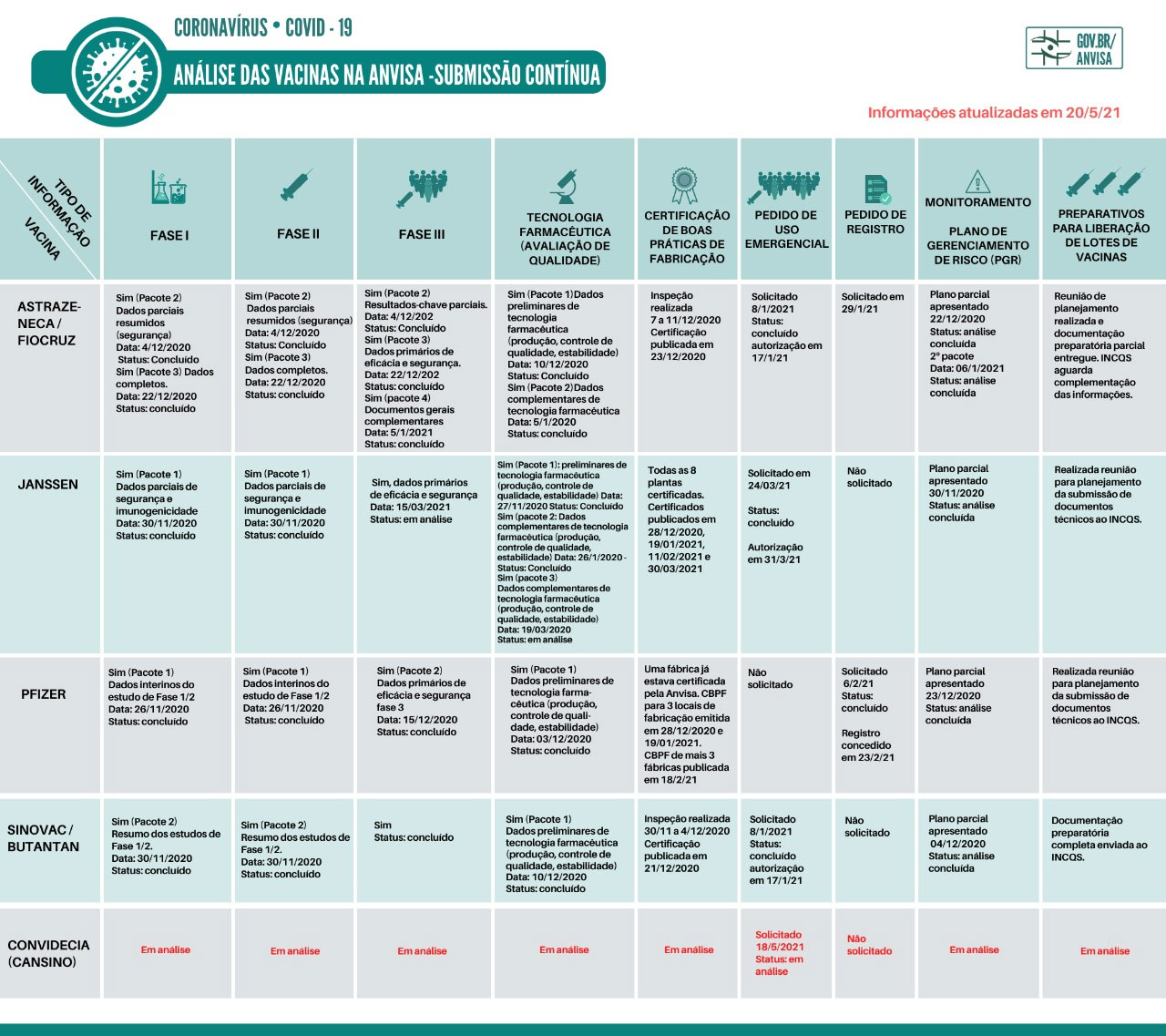
Fonte: Anvisa
A Organização Mundial da Saúde (OMS) acompanha o desenvolvimento das vacinas para Covid‑19 em todo o mundo. Os dados são consolidados e ficam disponíveis para downoad na sua página na internet.
Outra página da internet com informações atualizadas das vacinas em desenvolvimento para Covid‑19 é o da London School of Hygiene and Tropical Medicine. Nele pode-se encontrar dados dos estudos clínicos das vacinas e suas publicações científicas.
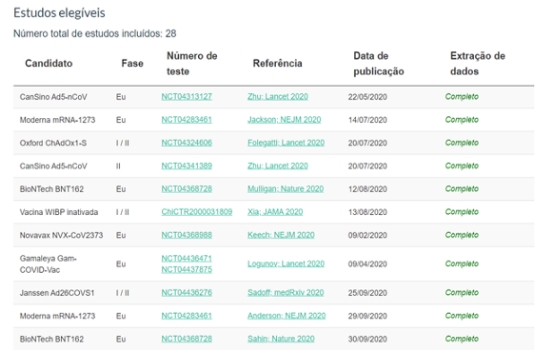
Fonte: Covid‑19 vaccine tracker
Até janeiro de 2021, foram publicados os resultados das análises interinas de dois estudos clínicos de fase III: o da vacina da Universidade de Oxford, com dados parciais; e o da vacina BioNTech/Pfizer/Instituto Butantan.