Módulo 2 | Aula 4 Aspectos que merecem destaque nas apreciações éticas
Nesta aula, ressaltaremos alguns aspectos que merecem destaque nas apreciações éticas.
Direito dos Participantes de Pesquisa
A função precípua de um comitê de ética em pesquisa é proteger os participantes de pesquisa. As resoluções que compõem o marco regulatório atual buscam contemplar os diferentes procedimentos e ações que caracterizam os diversos desenhos de pesquisa. Em julho de 2020, a Conep elaborou uma cartilha direcionada não só a este público como também aos pesquisadores, denominada “Cartilha dos Direitos dos Participantes de Pesquisa”. Foi elaborada com auxílio de representantes de participantes de pesquisa e conta com conteúdo e linguagem selecionados para que a informação seja compreendida de forma mais adequada.
Risco
Risco é um tema complexo que assume significados diferentes nos campos disciplinares, seja nas ciências biomédicas, seja nas ciências humanas e sociais. Podemos considerá-lo “quantificável” calculando a probabilidade de algo ocorrer ou não quantificável em que há incerteza sobre a possível ocorrência do evento, no entanto, ainda estamos falando de algo neutro, diferente de perigo, que está mais próximo do real, do concreto.
A discrepância entre a visão de “peritos/especialistas” (aqui pesquisadores) e o “público leigo” (potenciais participantes de pesquisa) apontada por Areosa (2010) fica evidente quando se pretende avaliar “risco” de uma pesquisa. Enquanto os primeiros pensam na frequência ou potência e podem relatar somente o que objetivamente conseguem medir, os participantes buscam informações que esclareçam consequências ou danos da intervenção proposta. Nas pesquisas sociais em saúde, em especial aquelas de abordagem qualitativa, nas quais os processos são complexos, imprevisíveis, incertos e percepções e representações do risco não são homogêneas e universais. Estabelecer uma avaliação de “risco” pode ser algo ainda mais abstrato e de difícil compreensão.
Tipificação das pesquisas com participantes humanos
A Resolução nº 674, de 06 de maio de 2022, do Conselho Nacional de Saúde estabeleceu novas diretrizes para a tipificação das pesquisas e estabeleceu fluxos específicos de tramitação para cada tipo de protocolo.
Elas foram classificadas, segundo o delineamento e o procedimento do estudo, em três tipos: A, B e C, nas quais:
Placebo
Segundo o Manual Merck Sharp & Dohme para profissionais, “placebos são substâncias inativas ou intervenções, utilizadas com maior frequência em estudos controlados para a comparação com fármacos potencialmente ativos”.
Observe a demonstração a seguir:
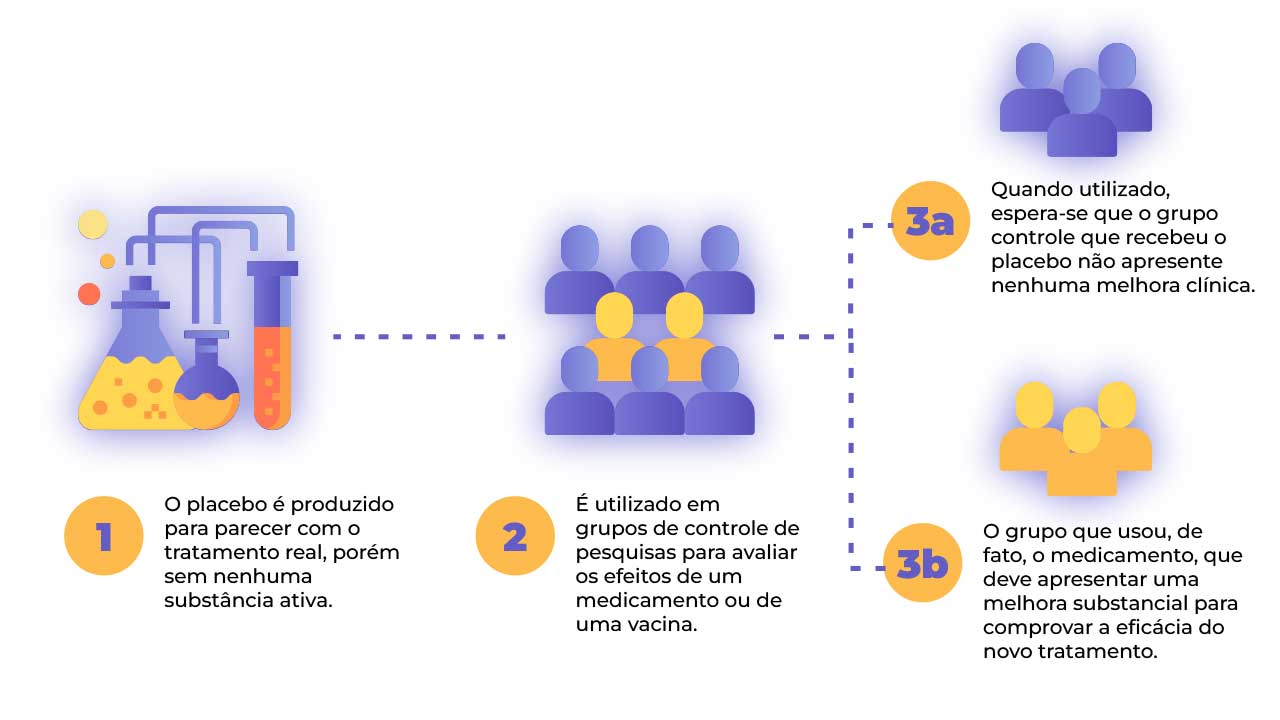
Por que um pesquisador daria uma substância ou realizaria um procedimento que sabidamente não tem efeito para determinada enfermidade ou sintoma?
O uso do placebo se justifica na necessidade de verificação da eficácia do tratamento/intervenção. Os pesquisadores, ao analisarem os dados obtidos dos participantes do estudo, precisam saber se o procedimento em teste teve um melhor desempenho quando comparado a um não tratamento (placebo). Relembre o caso da vacina para COVID-19. Antes de a ANVISA atestar a eficácia, alguns participantes da pesquisa receberam vacina para gripe. As pesquisas mostraram que os participantes que receberam a vacina da gripe (placebo) tiveram mais chances de desenvolver COVID-19 grave do que os que receberam a vacina específica para prevenir COVID-19. Note que sem a comparação entre os grupos não seria possível saber se a vacina era, de fato, eficaz. É importante notar que os participantes da pesquisa devem ser informados com transparência sobre a possibilidade de serem incluídos no grupo que receberá o placebo.
A Resolução CFM nº 1885 / 2008 prevê que “É vedado ao médico vínculo de qualquer natureza com pesquisas médicas envolvendo seres humanos, que utilizem placebo em seus experimentos, quando houver tratamento eficaz e efetivo para a doença pesquisada”.
Em alguns estudos clínicos, como por exemplo de novas terapias para câncer, não é correto deixar o paciente sem tratamento. Desta forma, todos os participantes da pesquisa recebem tratamento já existente. Além do tratamento padrão administrado a todos os participantes, um grupo receberá o medicamento teste e outro receberá o placebo.
Alguém poderia lembrar agora do chamado “efeito placebo”, quando indivíduos que receberam tratamento placebo apresentam alguma resposta clínica, apesar de não ter recebido o tratamento. O efeito placebo é frequentemente associado a um efeito psicológico, algo como um “pensamento positivo” ou a uma sensação subjetiva de melhora. Outros acreditam que ao menos parte do efeito placebo deve-se ao curso natural da doença. Nós podemos nos curar de forma espontânea. O que seria medido como efeito placebo poderia ser, em alguns casos, a medida da regressão natural da enfermidade. Outra hipótese é que um ambiente positivo de estímulo, cuidado e afeição pode ser capaz de disparar gatilhos terapêuticos do organismo que o levem a combater enfermidades. Seria um efeito da relação profissional-paciente.
Os placebos, todavia, também podem apresentar efeitos colaterais, chamados de nocebos. Tais efeitos são atribuídos também às expectativas que os indivíduos têm sobre o que poderiam sentir com o procedimento.
Duplo Padrão
O “double standard” (duplo padrão) se refere à existência de padrões éticos diferenciados para diferentes grupos que serão estudados em pesquisas. Trata-se de ser menos rigoroso nas exigências de proteção para grupos de participantes em comparação com os demais grupos de participantes. Os grupos mais frequentemente discriminados possuem condições socioeconômicas e proteção social precárias, populações em situação de vulnerabilidade, pessoas neurodivergentes ou com transtornos psiquiátricos, pessoas privadas de liberdade.
Pesquisas com coleta e/ou uso de material biológico humano
Para as pesquisas em que estejam previstas coleta de amostras biológicas de origem humana e/ou o uso de amostras armazenadas há de serem seguidas, além das orientações preconizadas pela Resolução 466, algumas orientações específicas, concernentes à coleta, uso e descarte ou armazenamento dessas amostras. Essas orientações encontram-se na Resolução 441, de 2011.
A Resolução CNS Nº 441, publicada em 12 de maio de 2011, trata das Diretrizes para Análise Ética de Projetos de Pesquisas que Envolvam Armazenamento de Material Biológico Humano ou Uso de Material Armazenado em Pesquisas. Juntamente com a Portaria nº 2.201/MS, publicada em setembro, no mesmo ano, representa o marco normativo para biobancos e biorrepositórios no Brasil tendo trazido grande avanço para a ética em pesquisa no país no que se refere às garantias e direitos dos indivíduos cedentes das amostras utilizadas para estes fins.
As normas conceituam biobancos e biorrepositórios, a saber:
- É “coleção organizada de material biológico humano e informações associadas, coletado e armazenado para fins de pesquisa, conforme regulamento ou normas técnicas, éticas e operacionais predefinidas, sob responsabilidade e gerenciamento institucional, sem fins comerciais”.
- O gerenciamento das amostras cabe à instituição.
- A guarda do material biológico é de responsabilidade institucional.
- É “coleção de material biológico humano, coletado e armazenado ao longo da execução de um projeto de pesquisa específico, conforme regulamento ou normas técnicas, éticas e operacionais predefinidas, sob responsabilidade institucional e sob gerenciamento do pesquisador, sem fins comerciais”.
- O gerenciamento das amostras cabe ao pesquisador responsável.
- A guarda do material biológico é de responsabilidade institucional.
De maneira geral, essas amostras podem ser coletadas para responder a uma pergunta específica de estudo e depois serem descartadas, ou então, o pesquisador pode ter o interesse em armazenar as amostras com pretensões de uso futuro, para outras pesquisas, para responder a outras perguntas/objetivos de estudo. Para cada situação, a Resolução CNS 441/11 descreve as regras a serem seguidas, que visam garantias, sejam relacionadas à responsabilidade e qualidade no processamento e armazenamento das amostras, sejam relacionadas aos direitos dos participantes das pesquisas. O pesquisador deve ter claro que toda amostra biológica pertence a um indivíduo e qualquer que seja a pretensão de seu uso ou seu destino, é ele quem deve decidir.
Desde a publicação das normativas, há a expectativa de que as instituições de pesquisa que trabalhem com material humano constituam seus próprios Biobancos, de modo a seguir uma tendência mundial. Quando a amostra é armazenada em um Biobanco institucional, pressupõe-se que esteja em uma estrutura mais adequada e, consequentemente, há maior confiabilidade em termos de qualidade, segurança, informações associadas, além de melhor harmonização com as diretrizes institucionais. Claro que, se as amostras forem específicas apenas para os objetivos de um determinado estudo, o biorrepositório, com a previsão de descarte após o tratamento e análise seria o mais indicado.
É importante lembrar que um biorrepositório só pode existir por 10 anos, prorrogáveis por mais 10 anos, e deve estar associado a um protocolo de pesquisa. Já o biobanco não tem prazo para armazenamento das amostras. Além disso, a existência de biorrepositórios não anula a constituição de um biobanco na mesma instituição.
Quando a amostra é coletada para armazenamento em um biobanco, o cedente deve autorizar em um consentimento específico, diferente do que for utilizado para a participação na pesquisa. Na cessão de sua amostra para o biobanco, deve constar a opção por ser contatado para todas as pesquisas que vierem a ser realizadas com sua amostra ou não. Quando a amostra é coletada para fins específicos da pesquisa o pesquisador deve esclarecer no Termo de Consentimento Livre e Esclarecido (TCLE) se o material, ao final da pesquisa, será descartado ou armazenado para utilização em pesquisas futuras. Para esta última opção, o participante, deverá ser contatado para consentir ou não o uso em nova pesquisa.
Os CEP trabalham de acordo com as orientações dispostas na Resolução CNS 441/11 e tanto para formação de biorrepositórios, como para a utilização de amostras armazenadas, é necessário que os TCLE contemplem todos os quesitos apresentados na norma. Cabe também destacar que há a possibilidade de que os participantes consintam com a coleta e uso de seus materiais biológicos de forma remota ou eletrônica. As orientações estão no Ofício Circular nº 23/2022/CONEP/SECNS/DGIP/SE/MS, sobre “Normatização do uso de consentimento e assentimento eletrônico para participantes de pesquisa e de biobancos”. Outros pontos de destaque na apreciação ética de projetos de pesquisa desta natureza são: o regulamento do biorrepositório e os acordos, porventura, existentes entre instituições parceiras, de forma que não implique em prejuízo aos direitos dos participantes envolvidos.
Pesquisa com população Indígena

Pesquisa com população indígena pertence a uma das áreas temáticas especiais, o que significa que, além do CEP da instituição proponente, terá de passar pelo crivo da Conep, seja no acesso aos indivíduos, aldeados ou não, à terra indígena ou mesmo com a utilização de banco de dados de acesso restrito desta população.
Para a realização de pesquisa nesta temática, além das Resoluções nº 466/12 e nº 510/16, a depender se for pesquisa clínica ou na área de ciências humanas e sociais, deve-se seguir as normativas da Resolução CNS nº 304/2000, que regulamenta as pesquisas com seres humanos na área de povos indígenas.
A Resolução CNS 304/2000 se fundamenta pelo precípuo interesse na proteção dos direitos dessa população. Para tal, destaca-se que o pesquisador deve “ter a concordância da comunidade alvo da pesquisa que pode ser obtida por intermédio das respectivas organizações indígenas ou conselhos locais, sem prejuízo do consentimento individual, que em comum acordo com as referidas comunidades designarão o intermediário para o contato entre pesquisador e a comunidade”. Outro ponto que merece destaque é que a pesquisa deve “respeitar a visão de mundo, os costumes, atitudes estéticas, crenças religiosas, organização social, filosofias peculiares, diferenças linguísticas e estrutura política”. A norma aborda, ainda, questões relacionadas às peculiaridades de cada povo e/ou comunidade; possibilidades de suspensão da pesquisa; armazenamento de material biológico e retorno dos resultados.
A autorização da liderança indígena é fundamental já na submissão do protocolo de pesquisa. E para entrada em terra indígena para pesquisa é necessária autorização da FUNAI, a ser obtida após aprovação da Conep.
Para a análise ética, o pesquisador deve descrever como se dará o processo para obtenção das autorizações de todas as lideranças e dos consentimentos individuais, por meio do termo ou registro de Consentimento Livre e Esclarecido.
Não se pode esquecer que, se a pesquisa envolver outras áreas temáticas, como genética, armazenamento de material biológico ou participação estrangeira, é necessário que sejam seguidas as demais normativas correspondentes.
Pesquisa com qualquer etapa desenvolvida em ambiente virtual

Pesquisas desenvolvidas em ambientes virtuais já tramitavam com relativa frequência em determinados CEP, especialmente naqueles mais próximos das Ciências Humanas e Sociais. E nesse sentido, a Resolução CNS 510/16 permitiu maior adequação na análise. No entanto, foi a partir da pandemia de COVID-19 que pesquisadores de outras áreas ampliaram suas formas de comunicação e coleta de dados, aumentando de forma significativa o número de pesquisas que desenvolvem alguma de suas etapas em ambientes virtuais.
Assim, desde o recrutamento de participantes de pesquisa, acompanhamento clínico até a aplicação de questionários ou entrevistas de forma remota foi apresentado em projetos de pesquisa. Ainda durante o período crítico da pandemia, a Conep publicou o Ofício Circular nº 2/2021/CONEP/SECNS/MS02 para orientar como proceder ao utilizar ferramentas em ambientes virtuais evitando expor dados e gerar malefícios aos participantes de pesquisa. O documento é iniciado como Termos e definições e dividido em quatro itens: submissão, procedimentos que envolvem contato através de meio virtual ou telefônicos com os possíveis participantes, segurança e armazenamento e conteúdo dos documentos tramitados.
O CEP/ENSP também publicou um interessante documento sobre o tema, “Orientações sobre Ética em Pesquisa em Ambientes Virtuais” visando “orientar pesquisadores e alunos nos cuidados ao escolher a ferramenta e as especificidades para o registro de consentimento dos participantes das pesquisas”. Esse documento detalha não só as possíveis ferramentas utilizadas nesses estudos, como também o ambiente virtual como campo de pesquisa.
Para não esquecer!
Questões fundamentais a serem consideradas antes de se iniciar uma pesquisa com seres humanos:
- Existe uma legítima dúvida científica a ser investigada? A dúvida é só minha ou é uma dúvida da comunidade científica?
- Disponho de meios e recursos apropriados para investigar essa questão em conformidade com os cânones científicos?
- Os riscos aos quais os participantes da pesquisa estarão potencialmente submetidos foram identificados e estabeleceu-se estratégias apropriadas para minimizá-los, controlá-los e solucionar os problemas deles decorrentes caso ocorram?
- Os benefícios que resultarão da participação na pesquisa para os participantes são reais e superam as possibilidades de danos?
- Há algum possível constrangimento para que quem for convidado a participar da pesquisa aceite participar?
- Os indivíduos convidados a participar da pesquisa compreendem os limites dos estudos e dos eventuais riscos e benefícios que dela podem advir?
- Os direitos individuais e coletivos dos participantes estão sendo respeitados?
