Aula 1
Hemorragia Pós-parto: prevenção, diagnóstico e manejo não cirúrgicos
Introdução
Hemorragia pós-parto (HPP) é definida como perda sanguínea cumulativa de 1.000 mL ou mais de sangue, ou qualquer perda acompanhada de sinais ou sintomas de hipovolemia, dentro de 24 horas após o nascimento, e independentemente da via de parto. Perdas sanguíneas superiores a 500 mL após partos vaginais também podem ser consideradas anormais, especialmente em populações mais vulneráveis.
A incidência de HPP é variável e há uma estimativa de que ela ocorra entre 1% e 10% dos partos, geralmente em países de baixa e média rendas. Atualmente, essa é a principal causa de morte materna no mundo, alcançando cerca de 80.000 mortes anuais.
Além da elevada mortalidade, há outro agravo em relação à HPP: um número expressivo de pacientes que sobrevivem a um quadro de HPP grave evolui com sequelas físicas e/ou emocionais.
Nesta aula queremos enfatizar que essas mortes, na maior parte, são consideradas evitáveis. Portanto, é essencial que todas as instituições e profissionais que prestam assistência ao parto estejam devidamente preparados para prevenir, diagnosticar e tratar um quadro de HPP.
Puérpera, recém-nato e profissionais de saúde

Medidas preventivas na HPP
A dimensão da morbimortalidade da HPP revela a importância de identificar os seus fatores de risco e realizar sua prevenção. Vamos entender melhor esses temas?
Entre os vários fatores de risco, destacam-se a anemia e as síndromes hipertensivas. A estratificação de risco é uma estratégia útil para a redução da morte materna por HPP. São fatores de alto risco: placenta prévia ou de inserção baixa, pré-eclâmpsia com sinais de gravidade, hematócrito < 30%, plaquetas < 100.000/mm3, sangramento ativo na admissão, coagulopatias, uso de anticoagulantes, descolamento prematuro da placenta e acretismo placentário.
As principais medidas preventivas para HPP são administração de ocitocina e manejo ativo do terceiro período do trabalho de parto. A ocitocina tem sido recomendada como medicação de primeira linha na prevenção da HPP, ressaltando-se que a ocitocina exige refrigeração e proteção da luz para que se possa garantir a qualidade de suas propriedades farmacológicas.
Clique aqui e saiba mais sobre medidas preventivas da HPP.
Diagnóstico da HPP e estimativa de perda sanguínea
Atualmente, o critério para o diagnóstico de HPP estabelece 1.000 mL cumulativos de perda sanguínea, independentemente da via de parto. Entretanto, principalmente se acompanhadas de fatores de risco, as perdas sanguíneas superiores a 500 mL após partos vaginais podem ser consideradas anormais.
Perdas acima de 1.000 mL podem ser classificadas como HPP grave e as superiores a 2.000 mL, como hemorragia maciça, habitualmente acompanhadas de queda da hemoglobina ≥ 4 g/dL, coagulopatia e necessidade de transfusão maciça. É importante considerar que os decréscimos dos níveis hematimétricos (hemoglobina, hematócrito) são tardios e não refletem, de imediato, as perdas sanguíneas. São representativos da perda sanguínea somente cerca de quatro horas após o início da hemorragia, sendo, assim, de uso limitado na abordagem da HPP aguda e grave. Além disso, a hipervolemia gestacional retarda a manifestação dos primeiros sinais de choque hipovolêmico, principalmente entre as gestantes sadias. Nessas, as alterações hemodinâmicas ocorrem somente após perdas superiores entre 20% e 30% da volemia (1.500 a 2.000 mL). Sendo assim, diante da evidência clínica de perda sanguínea acima do habitual, é necessário que não ocorram atrasos no tratamento.
As estratégias para diagnosticar e estimar a perda volêmica são variadas e incluem:
- Estimativa visual.
- Pesagem de compressas.
- Uso de dispositivos coletores.
-
Mensuração dos parâmetros clínicos, dentre os quais se destaca o índice de choque (IC).
A estimativa visual, que utiliza alguns parâmetros para quantificação do sangramento presente em compressas cirúrgicas, lençóis e poças da perda sanguínea, é simples e rápida, porém é subjetiva e subestima as perdas volumosas de duas a três vezes.
Já a pesagem de compressas, campos cirúrgicos, lençóis e demais insumos utilizados na assistência ao parto é útil, principalmente na HPP vinculada a cesáreas e histerectomias. Entretanto, exige sistematização assistencial, conhecimento e padronização do tamanho e peso dos insumos. Utilizando a equivalência de 1 mL de sangue e 1 grama de peso, a perda sanguínea em mL é obtida pelo cálculo da diferença entre o peso dos insumos contendo sangue e o peso seco deles.
Um outro recurso é realizar a estimativa com dispositivos coletores posicionados abaixo das nádegas logo após o parto vaginal, pois ela é útil e mais fidedigna do que as demais estratégias de estimativa da perda sanguínea. Porém, é também passível de falhas, porque pode sofrer interferência pela inclusão de líquido amniótico e urina, eliminados simultaneamente.
Apesar de os parâmetros clínicos (pressão arterial, frequência cardíaca - FC) serem marcadores diagnósticos mais tardios, são muito uteis na determinação da gravidade do choque, na avaliação da terapêutica instituída e na indicação de terapias adicionais. O IC é um adjuvante na estimativa da perda volêmica e um marcador mais precoce de instabilidade hemodinâmica, com valores que se correlacionam com a necessidade de hemotransfusão e transferência de cuidados. Seu cálculo é efetuado pela divisão da FC pela pressão arterial sistólica (PAS). Valores de IC ≥ 0,9 indicam perda sanguínea significativa e ≥ 1 (FC superior a PAS) sinalizam a necessidade de abordagem rápida e possibilidade de hemotransfusão em pacientes com HPP. O IC aumenta à medida que se agrava o estado hemodinâmico materno. Valores entre 1,3 e 1,7 (choque moderado) e > 1,7 (choque grave) são propostos como indicativos de avaliação da necessidade imediata de transfusão maciça. A mudança do ponto de corte do IC de ≥ 0,9 para ≥ 1 também é proposta, com o intuito de facilitar seu uso na prática clínica.
Hora de ouro na HPP
O controle precoce do sítio de sangramento é a estratégia mais eficaz para prevenir o choque hipovolêmico. Nesse contexto, tem se introduzido o termo “hora de ouro em obstetrícia”, o qual se refere a uma estratégia de controle do sítio hemorrágico dentro da primeira hora a partir de seu diagnóstico.
Fluxo de atendimento em caso de diagnóstico ou suspeita de HPP
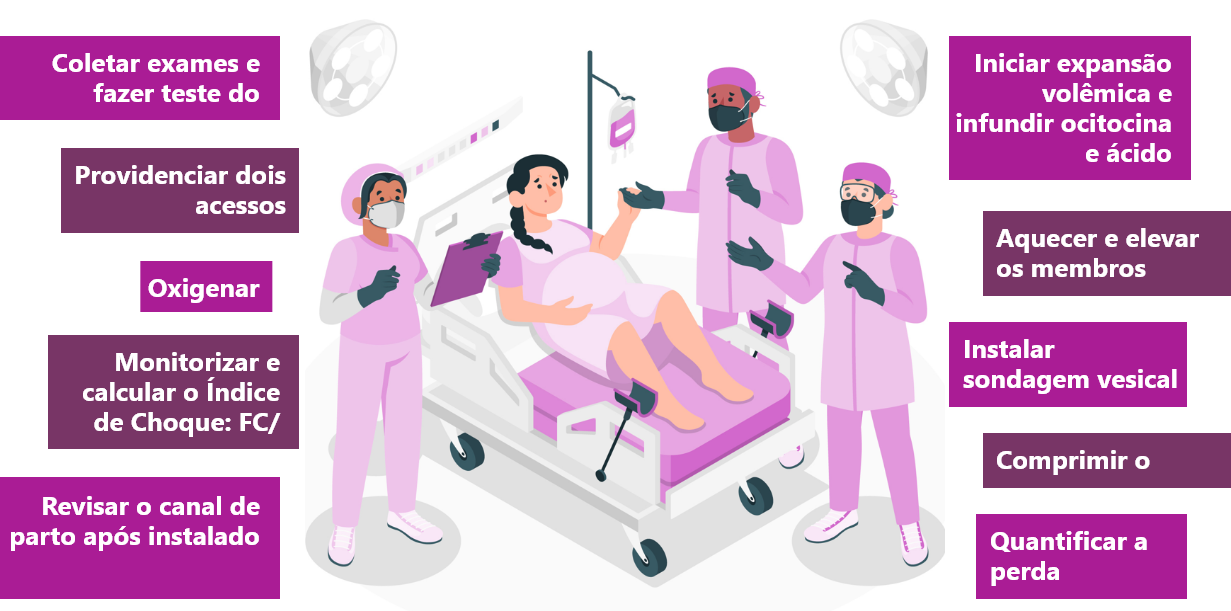
Sistema obstétrico de alerta e resposta para a HPP
O Sistema Obstétrico de Alerta e Resposta (SOAR) para HPP é um sistema de trabalho ordenado (bundle) que visa organizar e coordenar ações de redução do risco e da morbimortalidade por HPP. Esse sistema propõe a implementação de processos de trabalho que incluem a estratificação de risco de HPP, uso rotineiro e universal de uterotônicos após os partos, diagnóstico oportuno dos casos e monitoramento contínuo das pacientes.
Para garantir um atendimento seguro e efetivo, é essencial a organização dos fluxos assistenciais, com protocolos de manejo e transfusão maciça bem definidos e disponibilização de kits de HPP acessíveis a toda equipe assistencial.
O SOAR promove o envolvimento e a capacitação de equipes multidisciplinares e intersetoriais e estimula a implementação de um sistema de comunicação e aprendizado, ajudando no desenvolvimento de habilidades de liderança construtivas e permitindo um monitoramento contínuo das situações de risco. Ele também contribui para a organização da rede de saúde, visando a garantia dos fluxos assistenciais, a viabilização das transferências de cuidados e o acesso a tratamentos de maior complexidade.
Medidas terapêuticas iniciais na abordagem da HPP
As principais causas de HPP são atonia uterina, lacerações do trajeto, desordens placentárias e coagulopatia (os quatro Ts: tônus, trauma, tecido e trombina), cada uma exigindo uma abordagem específica. Quando um quadro de HPP é diagnosticado, toda a equipe assistencial deve conhecer os passos do tratamento de acordo com as causas e estar apta para realizá-los. Vale destacar que definir a etiologia hemorrágica e estimar a gravidade do quadro são passos essenciais no cuidado.
Independentemente da causa, é importante que toda a equipe esteja familiarizada com as medidas iniciais do atendimento. No cenário da HPP, a limitação de profissionais de saúde exige esforços para o sequenciamento correto no atendimento, reforçando a necessidade de kits e checklists, que, utilizados por profissionais treinados, são também fundamentais para a garantia do tratamento adequado. Vamos ver o fluxo de atendimento em caso de diagnóstico ou suspeita de HPP?
As medidas hemostáticas subsequentes, com definição do tratamento, devem ser instituídas de acordo com a etiologia. Quando disponível, um traje antichoque não pneumático (TAN) pode integrar essas medidas iniciais. Sequencialmente, reavaliam-se a perda volêmica e a repercussão hemodinâmica, na intenção de definir a necessidade de hemotransfusão.
Clique aqui e saiba mais sobre quando e como utilizar o TAN.
Como deve ser o manejo medicamentoso da HPP?
A ocitocina e o ácido tranexâmico devem ser os primeiros medicamentos infundidos na paciente com HPP. O ácido tranexâmico deve ser administrado o mais precocemente possível, pois a administração de uma primeira dose após três horas do início da HPP parece não ter benefício. A dose deve ser de 1 grama, endovenosa, diluída em 100 mL de soro fisiológico a 0,9%, em 10 minutos. Uma segunda dose (1 grama) deve ser administrada na persistência da hemorragia após 30 minutos.
Diante da reincidência do sangramento dentro das 24 horas de sua administração inicial, outra dose de 1 grama também pode ser infundida. Os esquemas de infusão dos uterotônicos são variáveis e elaborados para o tratamento da atonia uterina. Sugere-se a infusão inicial lenta (três minutos) de 5 unidades de ocitocina, seguidas de 20 a 40 unidades em 500 mL de soro fisiológico, administradas a 250 mL/hora. Um esquema sequencial de manutenção deve ser administrado a 125 mL/h, durante quatro horas. Em casos mais graves de atonia uterina, deve ser considerada a manutenção de ocitocina até 24 horas (67,5 mL/h ou 3 unidades/h), com vigilância para intoxicação hídrica.
Diante de resposta inadequada à ocitocina, a infusão sequencial de outros uterotônicos é necessária e o intervalo de tempo para a tomada de decisão não deve ser superior a 15 minutos, uma vez que são medicamentos de ação rápida. Na ausência de hipertensão arterial ou de uso de inibidores de protease, a metilergometrina (0,2 mg intramuscular) deve ser o segundo uterotônico a ser administrado, podendo ser repetida após 20 minutos. O uterotônico de terceira linha é a prostaglandina. Sugere-se a administração de 800 a 1.000 mcg de misoprostol, por via retal, uma vez que é a única formulação disponível no país.
Paralelamente ao uso dos uterotônicos, fazem-se necessárias a manutenção da compressão uterina (enquanto se aguarda o efeito medicamentoso) e a realização do teste do coágulo e da revisão do canal de parto, visando excluir as outras etiologias (lacerações de trajeto, rotura ou inversão uterina, retenção de material ovular, coagulopatias). Essas etiologias exigem tratamentos específicos, tais como curetagem uterina (restos ovulares), suturas (lacerações de trajeto), manobra de reposicionamento uterino (inversão uterina), laparotomia para reparo ou histerectomia (rotura uterina) e transfusão de hemocomponentes (coagulopatias). É fundamental a atenção para a associação de etiologias na determinação da hemorragia e de sua persistência.
Quando e como utilizar um balão de tamponamento intrauterino
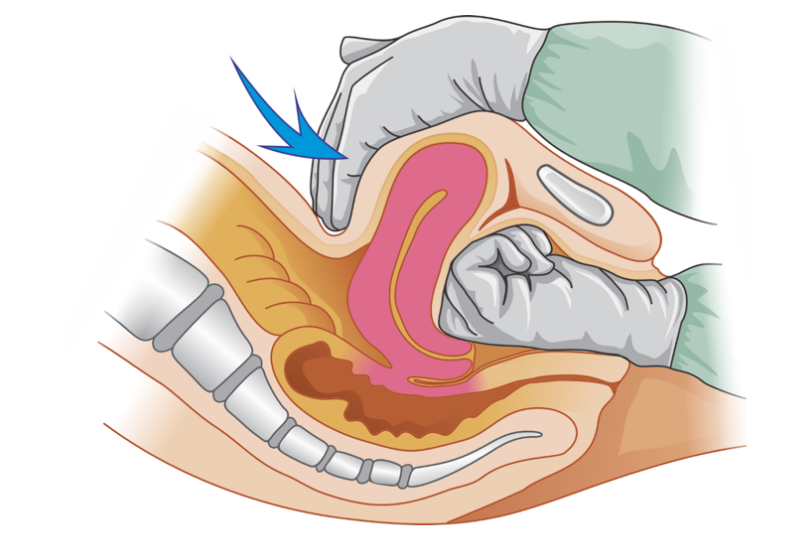
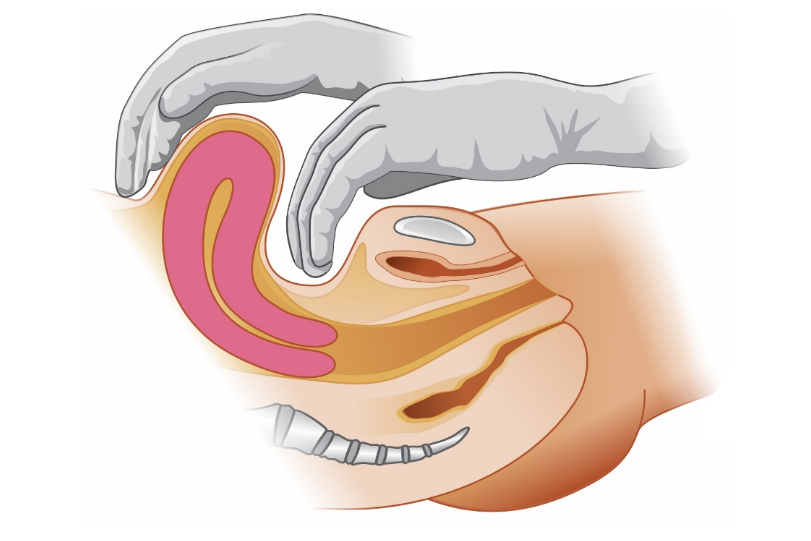
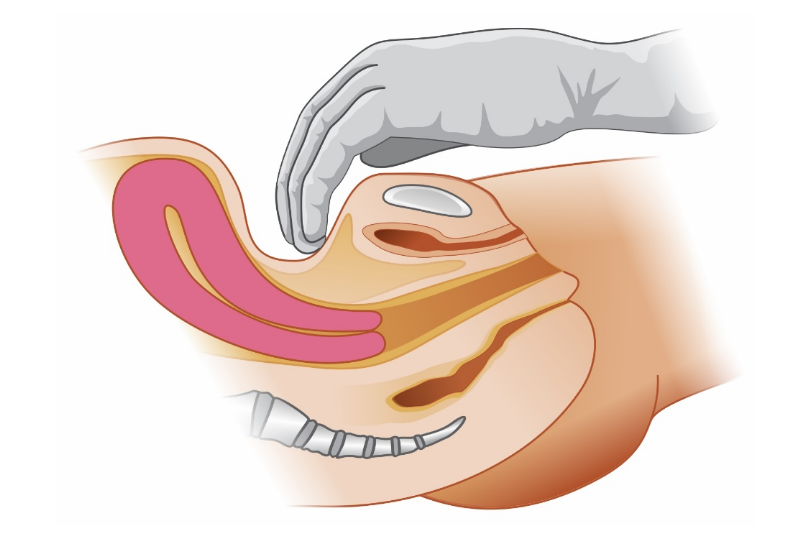
A principal indicação de um balão de tamponamento intrauterino (BIU) é a falha da terapia farmacológica na atonia uterina. Seu uso também está indicado no tratamento da hemorragia, ocorrendo após remoção de material ovular, porém com taxa de sucesso um pouco inferior à da atonia uterina. Nas situações mais leves do espectro da placenta acreta, ausentes de envolvimento miometrial profundo e adelgaçamento da parede uterina, seu uso cuidadoso, com infusões mínimas, também está indicado. Como o alcance de hemostasia transitória também é objetivo do tamponamento uterino, um balão pode ser temporariamente utilizado em pacientes que serão transportadas para unidades de referência ou naquelas com coagulopatia e que necessitam de terapias especificas, propiciando controle dos danos. A seguir veja como esse dispositivo funciona.
O mecanismo de controle hemorrágico do BIU ocorre por meio de elevação da pressão hidrostática contra a parede uterina, promovendo aumento da pressão capilar miometrial e redução do fluxo sanguíneo nas artérias uterinas, evidenciados pela dopplerfluxometria. Além disso, o dispositivo também parece promover estímulo mecânico às contrações uterinas.
No entanto, como todo procedimento, há algumas contraindicações em relação ao seu uso e as principais são:
- Gravidez.
- Infecções na genitália interna.
- Anomalias distorcendo a cavidade uterina e rotura uterina.
- Alergia aos componentes do balão.
-
Sangramento arterial que exige tratamento cirúrgico ou embolização.
Existe disponibilidade de dois tipos de BIU:
São exemplos desse tipo: Bakri, BT-Cath, Ebb, Zhukovskiy, Ellavi, Pergo, Kyoto. Veja alguns exemplos de BIU industrializados:
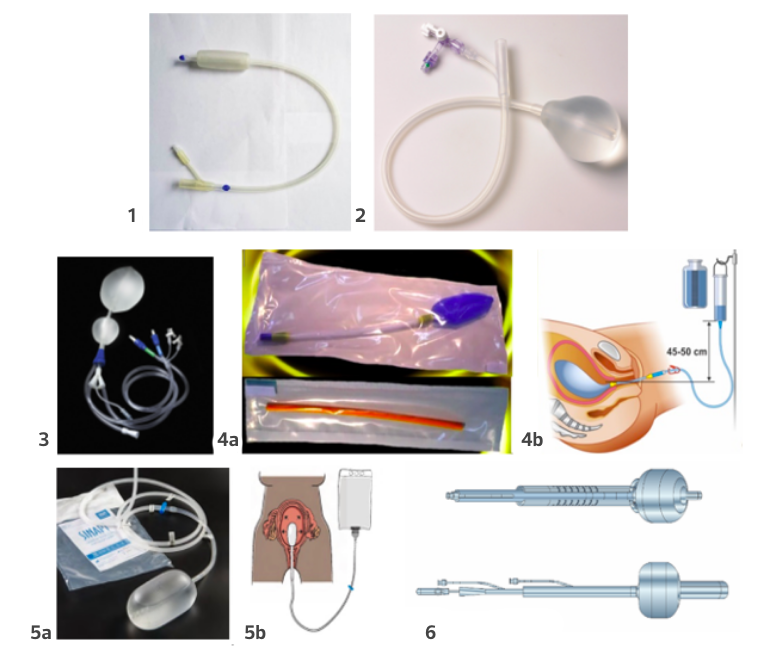
1 - Bakri
2 - BT-Cath / Pergo
3 - Ebb (Belfort-Dildy)
4a e 4b - Zhukovskiy
5a e 5b - Ellavi
6 - Kyoto
Diante da indisponibilidade do BIU industrializado, podem ser utilizados os artesanalmente manufaturados. São eles: Shivkar, Baskett, El Menia, El Hennawy, Alves.
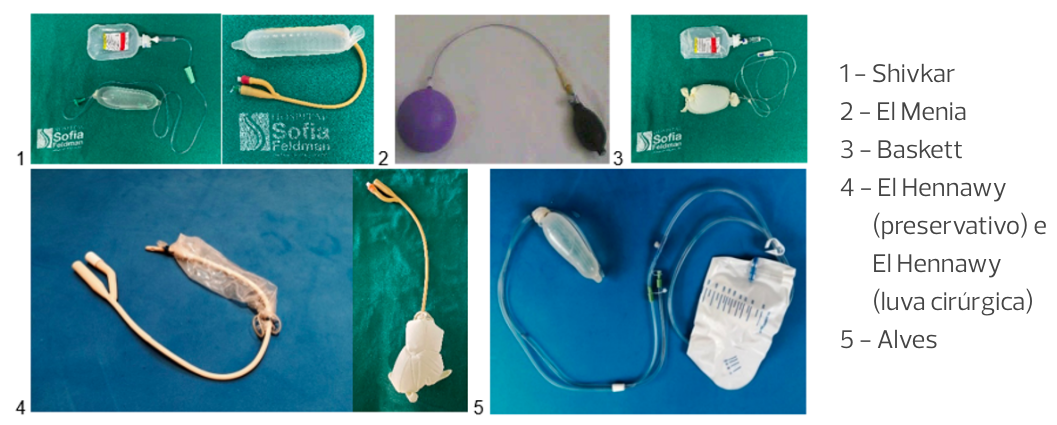
Os BIUs podem ou não possuir um sistema de drenagem sanguínea. O preparo para sua inserção pós-parto vaginal inclui, sequencialmente, antissepsia (vulvar, vaginal e cervical), sondagem vesical de demora e exposição da vagina e do colo uterino por meio de valvas vaginais. Após pinçar e tracionar o lábio anterior do colo uterino, a inserção intrauterina do balão pode ser realizada manualmente ou por meio de uma pinça Foerster, sendo recomendado o auxílio de ultrassonografia pélvica. Antes de infundir, o balão deve ser fixado, preferencialmente com compressas vaginais. Alternativamente, a fixação pode ser realizada por aplicação de pontos no colo uterino ou por apreensão das bordas do colo uterino com clipes vasculares ou pinças. Após a fixação, o balão é infundido com solução salina aquecida, utilizando-se seringas ou equipo.
Após o parto vaginal, a infusão recomendada é entre 350 e 500 mL. Na disponibilidade de um sistema de drenagem, ele deve ter sua permeabilidade verificada (infusão leve para certificar desobstrução) e ser conectado a uma bolsa coletora. Antibioticoprofilaxia (cefalosporina) e ocitocina em dose de manutenção devem ser administradas durante todo o tempo de tamponamento.
Durante a infusão, inicia-se a avaliação do teste do tamponamento. Redução significativa ou ausência de sangramento após infusão parcial ou máxima do balão são preditivas de sucesso do tamponamento, sendo, então, o teste considerado positivo. Habitualmente, o sangramento no segmento uterino inferior cessa após a infusão de 250 a 300 mL. Portanto, utilizar balões com sistema de drenagem otimiza o teste do tamponamento.
Os balões podem ser inseridos durante ou após cesarianas. Nessas situações, a infusão deve ser reduzida (250 a 300 mL), com a finalidade de evitar deiscência na histerorrafia. Na cesárea finalizada, a inserção é similar à do pós-parto vaginal. Já a inserção do balão durante a cesariana, a ser realizada preferencialmente pela rota abdominal (via histerotomia), é dificultada nos balões que possuem three-way.
Essa dificuldade pode ser contornada por meio da remoção do three-way, da aplicação de amarras comprimindo o eixo proximal do balão (vias de infusão e drenagem), e pela conexão de uma sonda flexível no eixo do balão, adaptando a sonda como um guia para a passagem inferior do balão pelo canal cervical. Após a passagem inferior do eixo do balão, um assistente traciona a extremidade proximal do dispositivo, reconecta o three-way e realiza a infusão. Uma alternativa é a introdução pela rota vaginal de uma pinça para dentro da cavidade uterina. O eixo proximal do balão é apreendido pela pinça e tracionado para a vagina. Caso essas estratégias não obtenham sucesso, o balão será inserido pela rota vaginal.
Técnica de Matsubara
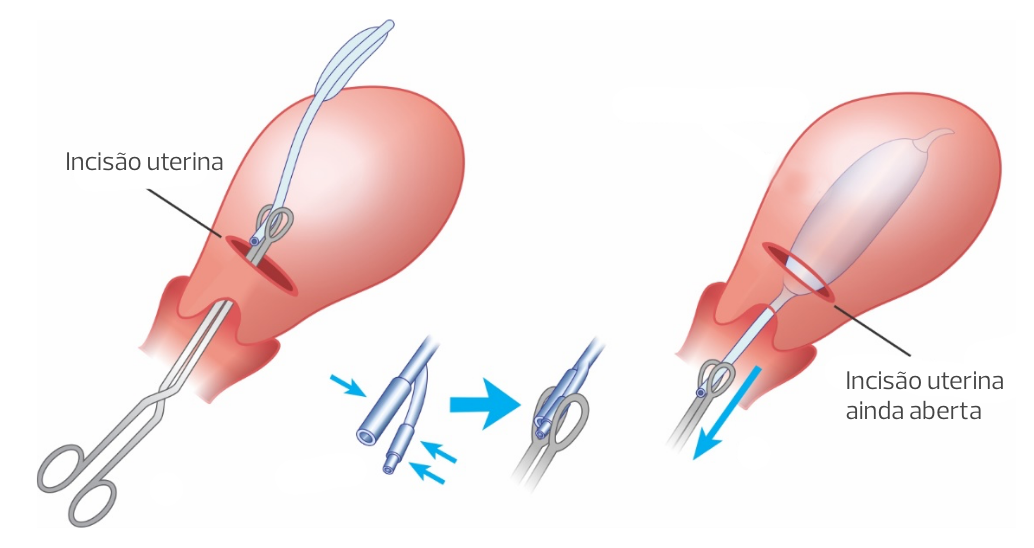
Outra dificuldade vinculada ao tamponamento com BIU em cesarianas é a manutenção do posicionamento correto do dispositivo na cavidade uterina durante a histerorrafia e manipulação uterina. A técnica “pescando” o eixo do balão pode ser utilizada para prevenir o deslocamento do dispositivo durante essas etapas. Um fio cirúrgico é amarrado na extremidade distal do dispositivo, rente à porção inferior do balão. Com o balão posicionado no fundo uterino, o fio é tracionado pelo auxiliar no sentido cefálico, por meio de um reparo, evitando-se o deslocamento (prolapso) vaginal do balão durante a histerorrafia. Após infusão do balão, efetuada pela via vaginal, o fio deve ser cortado rente à histerorrafia.
O tempo de permanência do BIU pode se estender por até 24 horas. Entretanto, diante do controle hemorrágico e da estabilidade hemodinâmica, a retirada precoce (12 horas) se encontra indicada, com o intuito de prevenir infecção. Recomenda-se o esvaziamento por etapas (100 mL a cada 15 minutos), porém o esvaziamento em etapa única também é aceitável. O esvaziamento e a remoção do BIU devem ser realizados durante o dia, com sala cirúrgica reservada e infusão de ocitocina de manutenção. Diante da recidiva hemorrágica durante o processo de retirada, o BIU deve ser reinfundido e a paciente, preparada para laparotomia.
Dispositivos intrauterinos de controle hemorrágico induzido por vácuo
Contemporaneamente, os dispositivos intrauterinos de controle hemorrágico induzido por vácuo surgem como uma nova tecnologia no tratamento invasivo não cirúrgico da HPP.
A aspiração sanguínea intrauterina, obtida por meio de vácuo de baixo nível (80 ± 10 mmHg), promove o esvaziamento sanguíneo contínuo da cavidade uterina, contratilidade da parede uterina e compressão do sistema vascular miometrial, com controle hemorrágico rápido.
O Sistema Jada é um dispositivo composto por uma alça distal elíptica de silicone, contendo 20 poros de aspiração, um selo cervical de fixação (infundido com 60 a 120 mL) e um tubo para conexão a uma fonte regulável de vácuo e recipiente graduado.
Sistema Jada
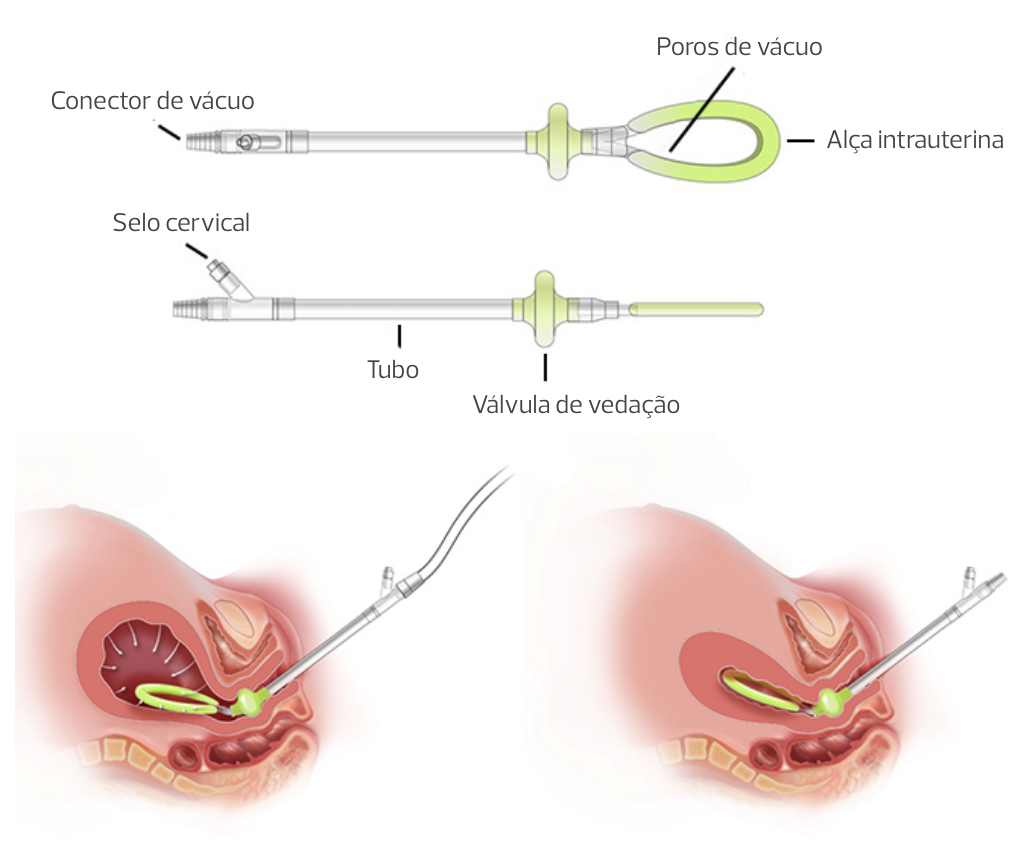
Até o momento, o Sistema Jada é o dispositivo de aspiração a vácuo mais estudado, principalmente na atonia uterina, tanto na HPP vaginal quanto na HPP cesárea, e seu uso tem apresentado altas taxas de sucesso total. Veja:
Taxas de sucesso do Sistema Jada
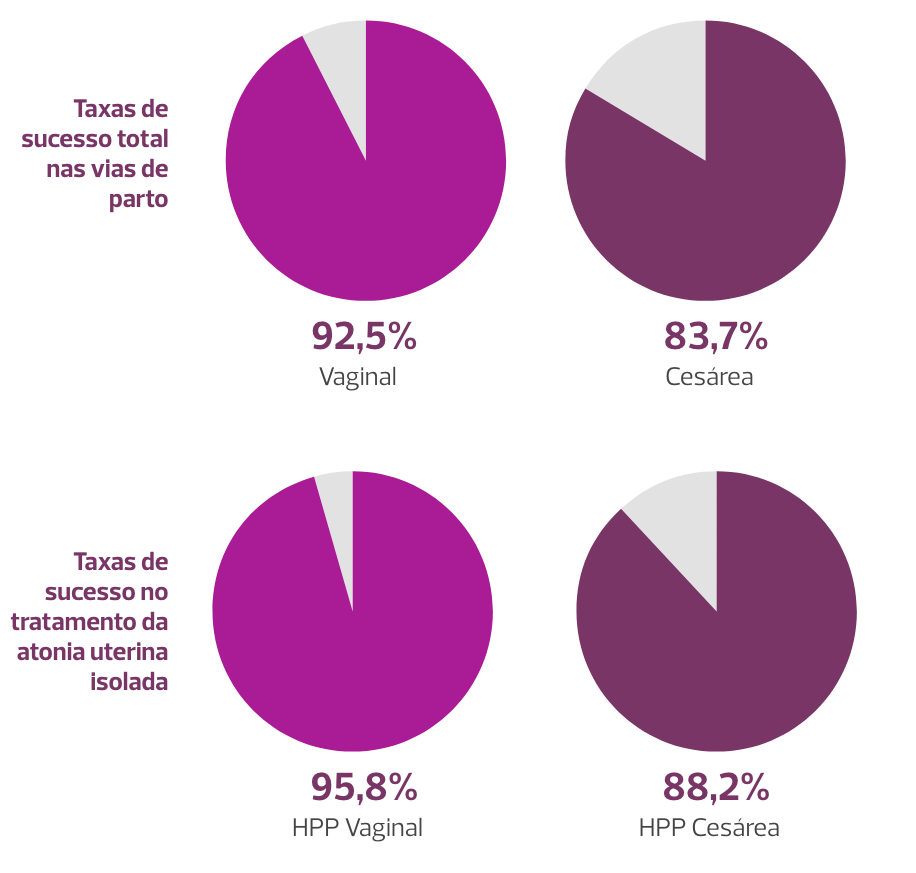
Assim como os BIU, parece propiciar obtenção rápida do controle hemorrágico logo após a instituição da aspiração a vácuo (entre um e cinco minutos). O tempo entre a inserção e a retirada do dispositivo é reduzido, com medianas de 3,1 e 4,6 horas em partos vaginais e cesárea, respectivamente, o que é reconhecido como uma vantagem em relação ao BIU.
O intervalo de tempo entre a dequitação placentária e a inserção do dispositivo é maior na HPP vinculada a cesarianas (mediana de 108 minutos) do que a partos vaginais (mediana de 31 minutos), pois a inserção é realizada somente após a finalização do ato cirúrgico, e pela rota vaginal (motivada pela presença do selo cervical de fixação).
Outros sistemas de aspiração a vácuo também têm sido estudados no tratamento invasivo da HPP, por meio da adaptação de balões ou de sondas na cavidade uterina, também nas duas vias de parto.
O BIU de Bakri conectado a um aspirador a vácuo pode ser adaptado na cavidade uterina para promover aspiração sanguínea continua. Por meio de uma infusão reduzida (50 a 100 mL), o balão é fixado no segmento uterino. Sua porção distal, provida dos orifícios de drenagem sanguínea, fica posicionada no fundo da cavidade uterina, propiciando a aspiração. Os relatos iniciais são de taxas de sucesso no controle da HPP superiores a 70%, com uso tanto no tratamento de atonia uterina quanto de patologias placentárias.
Balão de Bakri “a vácuo”
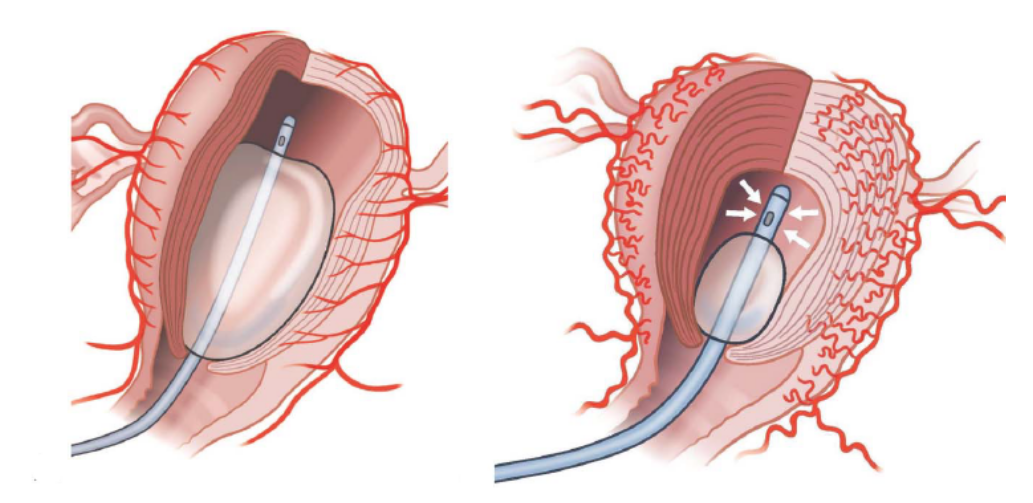
Sondas gástricas inseridas na cavidade uterina durante cesarianas e conectadas a sistemas de aspiração também já tiveram sua viabilidade e aceitabilidade testadas e aprovadas. A inserção foi realizada pela rota abdominal, com passagem da extremidade proximal da sonda pela histerotomia, seguida de apreensão vaginal e conexão ao aspirador a vácuo. A eficácia no tamponamento uterino induzido por vácuo ainda necessita de maiores avaliações, na intenção de apoiar sua recomendação no tratamento invasivo não cirúrgico da HPP.
Ressuscitação hemostática
Estima-se que 0,6% dos partos necessitam de uma abordagem hemoterápica motivada por choque hemorrágico. Nesse contexto, o conhecimento dos princípios da ressuscitação hemostática e a presença institucional de protocolo de hemotransfusão maciça, contemplando fluxo de transfusão emergencial, são essenciais em unidades de saúde que assistem partos.
Além de controle rápido do sangramento e de restauração da perfusão tecidual, a estratégia de tratamento do choque hemorrágico tem como objetivo a abordagem precoce de coagulopatia e de hipotermia. Temperaturas abaixo de 35 °C reduzem a perfusão tecidual de oxigênio, favorecendo a acidose e agravando a coagulopatia.
Na ressuscitação volêmica, a resposta deve ser avaliada a cada 500 mL de cristaloides infundidos. A infusão rápida e excessiva de cristaloides pode elevar a pressão arterial antes do controle cirúrgico do foco hemorrágico, aumentando paradoxalmente o sangramento (destruição de coágulos formados), favorecendo a hipotermia (líquidos não aquecidos) e diluindo os fatores de coagulação, o que aumenta o risco de coagulopatia dilucional e de evolução para tríade letal. Pacientes hemodinamicamente instáveis após a infusão de 1.500 mL de cristaloides, especialmente na vigência de sangramento ativo, devem ser avaliadas para hemotransfusão imediata. Após a infusão de 2.000 mL de cristaloides, a ressuscitação deve continuar com hemocomponentes.
O IC é útil em predizer a necessidade de hemotransfusão. Por se alterarem mais tardiamente, as dosagens de Hb e do Ht não são parâmetros úteis no manejo inicial de ressuscitação hemostática.
Os protocolos transfusionais atuais são variados e baseados em estudos de traumatologia. Porém, a evolução para quadros de hipofibrinogenemia é mais precoce na HPP, um aspecto importante a ser considerado na ressuscitação hemostática. Níveis de fibrinogênio abaixo de 200 mg/dL apresentam valor preditivo positivo de 100% para HPP grave. Sendo assim, a abordagem agressiva da hipofibrinogenemia é essencial.
A decisão transfusional inicial deve ser baseada no estado clínico da paciente (IC). As proporções do uso de hemocomponentes e as metas transfusionais devem estar contempladas nos protocolos.
A ressuscitação hemostática é usualmente necessária em pacientes sem resposta clínica a reposição volêmica inicial com cristaloides. Pacientes hemodinamicamente instáveis com perdas importantes devem receber transfusão emergencial de dois concentrados de hemácias. Se a prova cruzada não estiver disponível, deve ser transfundido sangue O negativo.
Em choque leve (IC ≥ 1), a hemotransfusão usualmente não é necessária e, caso ocorra, deve ser realizada com sangue compatível tipado. Diante do choque grave (IC > 1,7), a transfusão deve ser maciça, imediata e realizada, preferencialmente, com proporções iguais de concentrado de hemácias, plasma fresco congelado, crioprecipitado e plaquetas. O fibrinogênio deve ser dosado e, quando disponíveis, as provas viscoelásticas podem contribuir para a redução do uso de hemocomponentes. As metas terapêuticas são Hb > 8 g/dL, fibrinogênio ≥ 200 mg/dL, plaquetas ≥ 50.000/mm3 e RNI ≤ 1,5.
Transfusão maciça
| Estimativa da Perda | Nível de Consciência | Perfusão | Pulso | Pressão Arterial | Grau do Choque | Transfusão |
|---|---|---|---|---|---|---|
| 10-15% 500-1000 mL |
Normal | Normal | 60-90 | > 90 | Compensado | Usualmente não |
| 16-25% 1000-1500 mL |
Normal ou agitada |
Palidez, frieza | 91-100 | 80-90 | Leve | Possível |
| 26-35% 1500-2000 mL |
Agitada | Palidez, frieza e sudorese |
101-120 | 70-79 | Moderado | Usualmente requerida |
| > 35% > 2000 mL |
Letárgica ou inconsciente |
Palidez, frieza, sudorese e perfusão capilar > 3 seg |
> 120 | < 70 | Grave | Possível transfusão maciça |
Fim da aula
Nesta aula você viu que, sendo a HPP a maior causa de mortalidade materna no mundo, a capacidade das equipes assistenciais em prevenir, diagnosticar e instituir o manejo não cirúrgico dentro da “hora de ouro” se torna imprescindível.
A necessidade de realização simultânea de múltiplas ações para a abordagem terapêutica adequada da HPP justifica a presença de um sistema de trabalho ordenado nas unidades assistenciais. Para redução dos riscos e da morbimortalidade por HPP, é necessário implementar a estratificação de risco nos serviços de saúde e reduzir as dificuldades no manejo das pacientes, identificando precocemente os fatores de risco e otimizando a assistência pré-natal, ao parto e no pós-parto.
Você também viu que o uso sistemático de ocitocina profilática, de manejo ativo do terceiro período e de um método eficiente de estimativa da perda sanguínea, aliado a adequação diagnóstica e terapêutica, é uma prática que deve ser oferecida de forma padronizada e uniforme pelas equipes assistenciais.
Assim como a disponibilidade de BIUs, dispositivos intrauterinos a vácuo, TAN e de hemocomponentes, o conhecimento das ações que reduzem a morbimortalidade e o desenvolvimento de habilidades profissionais para o uso correto desses insumos complementam as necessidades assistenciais para um adequado manejo não cirúrgico da HPP.
Por fim, esperamos que, após esta aula, você possa apoiar a promoção de informações e de conscientização sobre a importância da valorização da vida das mulheres, da organização dos sistemas locais de saúde e da instituição de programas dedicados a prevenir a mortalidade materna, a otimizar as competências dos profissionais de saúde e a eliminar as barreiras ao acesso assistencial, pois esses são, essencialmente, os maiores desafios para reduzir a morbimortalidade por HPP.
- A HPP é a principal causa de morte materna e de histerectomia periparto no mundo.
- As principais etiologias de HPP são atonia uterina, trauma do canal de parto, retenção uterina de material ovular e distúrbios de coagulação.
- A estratificação de risco para HPP otimiza o planejamento da assistência e propicia a adoção precoce de medidas preventivas e terapêuticas.
- O controle precoce do foco de sangramento é a medida mais eficiente no tratamento da HPP, por isso a importância do conceito da hora de ouro no cuidado obstétrico.
- O índice de choque é o método clínico de escolha na estimativa da perda sanguínea, também sendo útil na predição de hemotransfusões.
- Os principais medicamentos utilizados na terapia farmacológica da HPP são os uterotônicos em casos de atonia e o ácido tranexâmico, que deve ser utilizado em todos os casos, independentemente da etiologia da hemorragia.
- Diante da falha da terapia farmacológica na atonia uterina ocorrendo após partos vaginais, o balão de tamponamento intrauterino e/ou o sistema de aspiração a vácuo devem anteceder a abordagem cirúrgica.
- Quando disponível, o TAN é útil no controle transitório da HPP, especialmente em pacientes com instabilidade hemodinâmica, viabilizando a continuidade do tratamento e as transferências de pacientes.
Recomendações
- Toda gestante com cesárea(s) anterior(es) deve realizar ultrassonografia para determinar a localização placentária. Caso a placenta seja prévia ou implantada no segmento uterino, estão indicados a investigação dos sinais ultrassonográficos de acretismo placentário e o encaminhamento para serviço de referência para a continuidade do cuidado. Diante da suspeita de invasão parametrial e em placentas prévias posteriores, a ressonância nuclear magnética ou a ultrassonografia tridimensional podem contribuir para a investigação. O parto dessas gestantes deve ocorrer em serviço terciário.
- A principal medida preventiva da HPP é a administração intramuscular de 10 unidades de ocitocina imediatamente após o nascimento, associada ao manejo ativo do terceiro período, realizado por profissional treinado. A ocitocina exige refrigeração para garantia de sua qualidade. Nos locais onde a ocitocina não estiver disponível ou quando sua qualidade não estiver garantida, é recomendado o uso de outros uterotônicos na profilaxia, a citar: carbetocina, metilergometrina (excluir na hipertensão) ou misoprostol. O uso rotineiro de ácido tranexâmico para profilaxia da hemorragia após partos vaginais ou cesarianas não é recomendado.
- O monitoramento do tônus uterino (gentil massagem) após o parto é recomendado como estratégia de identificação precoce de quadros de atonia uterina.
- A estimativa da perda sanguínea pode ser realizada por avaliação visual, pesagem de compressas cirúrgicas, uso de dispositivos coletores ou por métodos clínicos.
- Diante do diagnóstico de HPP, o tratamento deve ser iniciado imediatamente. O sequenciamento do atendimento deve incluir solicitação de ajuda, realização de manobra de compressão uterina, avaliação rápida da etiologia, manutenção da oxigenação e da perfusão tecidual, sondagem vesical, obtenção de acessos venosos calibrosos com coleta de amostra sanguínea e solicitação de exames laboratoriais, reposição da volemia, administração de ácido tranexâmico e de uterotônicos, avaliação da antibioticoprofilaxia e estimativa da perda sanguínea.
- A ocitocina intravenosa é o uterotônico de primeira linha no tratamento de atonia uterina. O ácido tranexâmico, na dose intravenosa de 1 grama em infusão de 10 minutos, deve ser administrado logo após o diagnóstico, independentemente da etiologia hemorrágica. Doses intravenosas adicionais de 1 grama devem ser administradas se o sangramento persistir após 30 minutos ou diante de recidiva da hemorragia dentro das 24 horas, contados a partir da primeira dose.
- O TAN não substitui as ações terapêuticas e deve estar vinculado a um protocolo assistencial de HPP.
- A ressuscitação volêmica com cristaloides não deve exceder 2.000 mL, e a transfusão de componentes sanguíneos se encontra usualmente indicada diante de choque hipovolêmico, principalmente se moderado ou grave. Pacientes hemodinamicamente instáveis, com perdas sanguíneas importantes, são candidatas a receber transfusão emergencial de dois concentrados de hemácias. Se a prova cruzada não estiver disponível, deve ser transfundido sangue O negativo.
- O balão de tamponamento intrauterino pode ser inserido após o parto vaginal e durante ou após a cesariana, com volumes específicos de infusão. Em função do teste do tamponamento, os balões com sistemas de drenagem sanguínea devem ser preferenciais. Uterotônicos e antibióticos devem ser administrados durante todo o tempo do tamponamento. A retirada do balão deve ocorrer após estabilidade hemodinâmica, preferencialmente antes de 12 horas, e com sala cirúrgica reservada.
-
Os dispositivos intrauterinos de controle hemorrágico induzido a vácuo também são recomendados para o tratamento invasivo não cirúrgico da HPP não responsiva ao tratamento farmacológico. Além de elevada taxa de sucesso no controle hemorrágico nas duas vias de parto, oferecem a vantagem de reduzir o tempo entre a inserção e a retirada do dispositivo.
Você concluiu esta aula, continue se empenhando nos seus estudos. Siga para a próxima aula!